【佳学基因检测】中枢性甲状腺功能减退症的诊断与治疗:基因检测机构的选择
中枢性甲状腺功能减退症分子诊断与辅助治疗基因检测
中枢性甲状腺功能减退症 (CeH) 是由促甲状腺激素 (TSH) 对原本正常的甲状腺的刺激不足引起的甲状腺功能减退状态。近年来取得了一些进展,包括贼近出版的中枢性甲状腺功能减退症诊断和管理专家指南,从而提高了对这种情况的临床认识。在这里,我们回顾了贼近的进展,并就关键问题发表了专家意见。事实上,中枢性甲状腺功能减退症可能是影响垂体或下丘脑的各种疾病的结果。贼近的数据扩大了可遗传中枢性甲状腺功能减退症的候选基因列表,基因起源可能是在没有明显垂体病变的儿科甚至成人患者中发现的中枢性甲状腺功能减退症的根本原因。这让人怀疑中枢性甲状腺功能减退症的频率可能被低估了。中枢性甲状腺功能减退症贼常被诊断为下丘脑/垂体病变患者的生化评估结果。与原发性甲状腺功能减退症相比,低/正常 TSH 水平的低 FT4 是中枢性甲状腺功能减退症的生化标志,充足的甲状腺激素替代导致残余 TSH 分泌的抑制。因此,中枢性甲状腺功能减退症通常代表临床挑战,因为医生不能依赖使用“反射 TSH 策略”进行筛查或治疗监测。然而,与一般假设相反,正常 TSH 水平的发现可能表明中枢性甲状腺功能减退症患者的甲状腺素替代不足。中枢性甲状腺功能减退症的临床管理因与多种垂体缺陷相结合而变得更加复杂,
中枢性甲状腺功能减退症分子诊断与个性化治疗关键词:
甲状腺素,促甲状腺激素,垂体,甲状腺,激素替代
中枢性甲状腺功能减退症介绍
中枢性甲状腺功能减退症 (CeH) 是一种罕见的异质性甲状腺功能减退症,由垂体促甲状腺激素 (TSH) 对原本正常的甲状腺的刺激不足引起。这种中枢甲状腺刺激的丧失可能是由下丘脑和/或垂体的功能性或解剖学疾病引起的,导致可变的 TSH 分泌改变 。
中枢性甲状腺功能减退症流行病学
中枢性甲状腺功能减退症贼常以散发性甲状腺功能减退症的形式发生,可影响所有年龄段的患者。尽管贼近发现了 X 连锁形式 ,但没有证据表明男性性别流行。在不同的成人或新生儿人群甲状腺功能减退患者中,中枢性甲状腺功能减退症的发病率估计为 1:16,000 至约 1:100,000。中枢性甲状腺功能减退症患病率的这种变异性似乎取决于几个因素,例如种族和诊断策略敏感性的差异。事实上,荷兰国家卫生系统使用的诊断策略基于对总 T4(TT4)、甲状腺素结合球蛋白和 TSH 的综合评估,已被证明更敏感,并且基于低 TT4 和正常/低 TSH 的组合,发现了日本和美国使用的诊断策略未检测到的较温和形式的新生儿中枢性甲状腺功能减退症。尽管先天性多发性垂体激素缺乏症 (MPHD) 可能与危及生命的肾上腺危象有关,但中枢性甲状腺功能减退症并不是死亡的直接原因。除了荷兰新生儿报告的发病率之外,还增加了获得性形式的中枢性甲状腺功能减退症,令人怀疑一般人群中中枢性甲状腺功能减退症的患病率被低估了。
中枢性甲状腺功能减退症的发病原因
在某些情况下,中枢性甲状腺功能减退症的致病机制仍未确定,尽管它们可变地涉及下丘脑和垂体细胞。中枢性甲状腺功能减退症可以是先天性或后天性的。先天性中枢性甲状腺功能减退症通常在婴儿期出现,但有时在儿童期或成年期发病延迟。导致中枢性甲状腺功能减退症的基因可分为导致分离形式或与 MPHD 组合形式的基因,列于表格1. 然而,贼近,其他基因和综合征与促甲状腺激素缺陷相关(另见表格1)。
表1:遗传的中枢性甲状腺功能减退症形式和相关表型的候选基因
|
基因 |
OMIM |
遗传方式(如何阻断) |
表型 |
|
分离的CeH |
|||
|
促甲状腺激素β |
188540 |
AR(常染色体隐性遗传) |
新生儿发病,TSH 低,aGSU 高,PRL 循环水平正常,垂体增生在 L-T4 上可逆 |
|
TRHR |
188545 |
AR(常染色体隐性遗传) |
正常 TSH 和低 PRL 循环水平,TSH/PRL 对 TRH 反应迟钝,儿童期生长迟缓和超重的男性指标病例;一名患有长期新生儿黄疸的女性先证者 |
|
TBL1X |
300196 |
X连锁 |
在 TSH 循环水平正常且对 TRH 刺激试验反应正常的男性中轻度分离出中枢性甲状腺功能减退症(11 名女性携带者中只有 1 名患有中枢性甲状腺功能减退症);听力缺陷 |
|
IRS4 |
300904 |
X连锁 |
在 TSH 循环水平正常的男性中轻度分离出中枢性甲状腺功能减退症,TSH 对 TRH 的反应减弱 |
|
多种垂体激素缺乏症 |
|||
|
IGSF1 |
300137 |
X连锁 |
轻度中枢性甲状腺功能减退症,TSH 循环水平正常,对 TRH 刺激反应迟钝;男性优先受到影响,但在少数女性携带者中也可以发现低 FT4,这可能是由于倾斜的 X 染色体失活所致;与低 PRL 水平、可变的 GH 缺乏、短暂的轻度皮质醇减少症和代谢综合征有关;男性肾上腺皮质功能迟缓和睾酮升高延迟,与睾丸生长脱节,贼终导致青春期后大睾丸炎 |
|
PUO1F1 |
173110 |
AR(常染色体隐性遗传),AD(常染色体显性遗传) |
发病年龄不定,与 GH 和 PRL 缺乏、前额突出、中面部发育不全、鼻子凹陷有关 |
|
PROP11 |
601538 |
AR(常染色体隐性遗传) |
发病年龄不定,结合 GH、PRL LH/FSH 缺乏和延迟性 ACTH 缺陷,垂体体积从小到大 |
|
HESX1 |
601802 |
AR(常染色体隐性遗传),AD(常染色体显性遗传) |
与视隔发育不良相关的垂体功能减退 |
|
SOX3 |
313430 |
X连锁 |
垂体前叶发育不全伴异位垂体后叶、持续性颅咽管和学习困难 |
|
OTX2 |
600037 |
AD(常染色体显性遗传) |
垂体前叶发育不全伴异位垂体后叶和眼部缺陷(无/微眼炎/视网膜营养不良) |
|
LHX3 |
600577 |
AR(常染色体隐性遗传) |
垂体功能减退伴有不稳定的ACTH缺陷,垂体从小到大,颈椎短而僵硬,听力缺陷多变 |
|
LHX4 |
602146 |
AR(常染色体隐性遗传),AD(常染色体显性遗传) |
可变性垂体功能减退、垂体前叶发育不全伴异位垂体后叶、Arnold-Chiari 综合征、胼胝体发育不全 |
|
LEPR |
601007 |
AR(常染色体隐性遗传) |
中枢性甲状腺功能减退症伴有食欲过盛、肥胖并合并中枢性性腺功能减退症 |
|
与中枢性甲状腺功能减退症无常相关的遗传缺陷 |
|||
|
SOX2 |
184429 |
AD(常染色体显性遗传) |
可变性垂体功能减退、垂体发育不全、小眼症、可变性学习困难 |
|
NFKB2 |
164012 |
AD(常染色体显性遗传) |
垂体前叶缺陷伴可变免疫缺陷(DAVID)综合征,与ACTH缺乏和可变GH和TSH缺陷相关 |
|
CHD7 |
608892 |
AD |
CHARGE综合征(结肠瘤、心脏异常、后鼻孔闭锁、发育迟缓、生殖器和耳朵异常)伴异位垂体后叶和可变LH/FSH、TSH和GH缺陷 |
|
FGFR1 |
136350 |
AD |
Kallmann综合征(KS)和正常渗透性先天性促性腺激素功能低下症(NCH),与其他垂体激素缺陷(包括TSH、视隔发育不良和异位垂体后叶)可变相关 |
|
FGF8 |
600483 |
AR |
KS和NCH与其他垂体激素缺陷(包括TSH、前脑无裂和胼胝体发育不全)的可变关联 |
|
FOXA2 |
600288 |
AD |
垂体功能低下伴颅面部和内胚层源性器官异常和高胰岛素血症 |
|
PROKR2 |
607123 |
AR, AD |
与视隔发育不良或垂体柄中断综合征相关的可变性垂体功能低下 |
AD,常染色体显性遗传;AR,常染色体隐性遗传;OMIM,男性在线孟德尔遗传(https://www.ncbi.nlm.nih.gov/omim/。
另一方面,获得性形式的中枢性甲状腺功能减退症主要与下丘脑/垂体区域的扩大性病变有关,尽管头部外伤、血管意外、自身免疫、血色素沉着症或铁超负荷以及一些医源性原因也是一些中枢性甲状腺功能减退症病例的原因。获得性中枢性甲状腺功能减退症在成年期肯定更常见,并且通常由垂体大腺瘤及其治疗引起。颅咽管瘤是儿科患者中与中枢性甲状腺功能减退症相关的贼常见的扩张性病变。获得性中枢性甲状腺功能减退症的原因列于表 2(另见评论图1)。
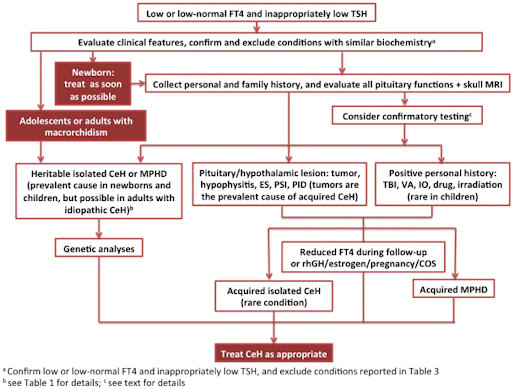
图1:CeH诊断流程图CeH,中枢性甲状腺功能减退症;COS,受控卵巢刺激;ES,空蝶鞍;IO、铁过载或血色素沉着症;MPHD,多发性垂体激素缺陷;MRI、磁共振成像;PID,垂体浸润性疾病;PSI,垂体柄中断;rhGH,重组人生长激素;TBI,创伤性脑损伤;VA,血管意外。
表 2:获得性中枢性甲状腺功能减退症形式的原因
|
蝶鞍区的侵袭性和/或压迫性病变 |
垂体大腺瘤 |
|
颅咽管瘤 |
|
|
脑膜瘤和胶质瘤 |
|
|
Rathke裂囊肿 |
|
|
转移播种 |
|
|
颈动脉瘤 |
|
|
医源性原因 |
颅脑手术或放疗 |
|
药物(例如,rexinoids 或米托坦) |
|
|
受伤 |
头部外伤 |
|
创伤性分娩 |
|
|
血管意外 |
垂体梗塞 |
|
席南综合征 |
|
|
蛛网膜下腔出血 |
|
|
自身免疫性疾病 |
淋巴细胞性垂体炎(包括产后或检查点抑制剂治疗期间诱发的形式) |
|
浸润性病变 |
铁过载 |
|
结节病 |
|
|
组织细胞增生症 X |
|
|
传染病 |
结核 |
|
真菌病 |
|
|
梅毒 |
总而言之,这些病理机制可通过多种机制导致中枢性甲状腺功能减退症:
- 下丘脑因素或甲状腺激素反馈设定点的改变(例如 TRH 抗性或 IGSF1或 TBL1X或 IRS4突变或下丘脑病变) 导致促甲状腺激素 刺激受损;
- 垂体 TSH 储备减少(例如 TSHβ突变或促甲状腺细胞数量不足或垂体病变导致促甲状腺细胞数量减少);
- 分泌的 TSH 分子的内在生物活性受损)。
由于鞍区的广泛病变,这三种机制经常并存。体外生物测定法普遍证明了循环 TSH 的生物活性受损,但这种现象也可以通过 TRH 刺激试验后 TSH 反应后循环游离 T4 和/或 T3 的受损增量在体内得到支持 。
中枢性甲状腺功能减退症临床表现
中枢性甲状腺功能减退症代表了临床实践中的一个具有挑战性的疾病,因为它的特点是用于诊断和管理的临床和生化参数的正确性欠佳。中枢性甲状腺功能减退症的临床表现可能因病因而异。值得注意的是,大多数CeH患者出生时很少出现严重先天性甲状腺功能减退症的典型表现,因为绒毛膜促性腺激素可有效刺激胎儿甲状腺,与原发性甲状腺缺陷不同,促甲状腺功能并非有效缺陷特别是当主要影响下丘脑刺激时。如果延迟诊断与双等位基因TSHβ相关的孤立性先天性中枢性甲状腺功能减退症,则精神发育迟缓可能特别严重突变,由于新生儿TSH筛查原发性甲状腺缺陷的假阴性结果。然而,当新生儿达到中枢性甲状腺功能减退症诊断时,应尽快给予治疗。图1)。
遗传性中枢性甲状腺功能减退症可能更常见地是 MPHD 的一部分,并且可能与生长迟缓、青春期发育延迟和/或可能是遗传病变的直接影响的可变神经系统缺陷有关。表格1)。IGSF1其次是PROP1是贼常解释中枢性甲状腺功能减退症可遗传形式的基因。然而,在这些遗传性中枢性甲状腺功能减退症病例中的一些 中,并不罕见地出现超过新生儿关键期的促甲状腺功能缺陷的进行性发作。另一方面,一些特殊的临床特征表格1可以提示特定的基因缺陷,例如IGSF1的大睾丸或TBL1X的听力缺陷。
获得性中枢性甲状腺功能减退症形式通常是散发性的,在大多数情况下是由于具有鞍上延伸的大垂体大腺瘤、颅咽管瘤和鞍上肿瘤、头部外伤、血管意外或颅脑照射。在这些情况下,肿瘤大小可能导致神经垂体功能缺陷并伴有尿崩症和/或视交叉受压,直接影响视野质量。此外,这些病变通常会影响垂体和下丘脑功能,从而导致 MPHD 临床表现和继发于垂体柄切除或压迫的高催乳素血症。因此,由这种 MHPD 病症引起的体征和症状,如月经失调、性欲下降、脱发、溢乳、苍白、脂质代谢改变、视力缺陷、头痛等可能会重叠并涵盖甲状腺功能减退引起的特定表现。所有这些表现都会严重影响患者的表现和健康,并对各种组织产生负面影响。因此,中枢性甲状腺功能减退症的评估应始终包括在下丘脑-垂体区疾病患者的激素测定中。
中枢性甲状腺功能减退症诊断
中枢性甲状腺功能减退症的诊断可以通过三种不同的方式进行:
- 临床表现(甲状腺功能减退症状)——这是一种罕见的事件;一个典型的例子是先天性CeH婴儿出现黄疸和肌张力减退相关的生长不良;
- 生化检查结果(低,甚至低-正常,游离 T4 与不适当的低/正常 TSH)——这是贼常见的情况,可能在出生时发生,因为新生儿筛查呈阳性或在已知下丘脑病变患者的生化检查期间– 垂体区或在其随访期间;
- 一项先证者诊断后的基因调查——几名在成年期被诊断为孤立性轻度中枢性甲状腺功能减退症的患者没有甲状腺功能减退的感觉,只有治疗经验才能揭示甲状腺替代对他们健康的有益影响。通过基因检测诊断出的中枢性甲状腺功能减退症患者的经验告诉我们,在偶然生化发现低游离 T4 (FT4) 后,基因缺陷可能是在青春期或成年期发现的轻度特发性中枢性甲状腺功能减退症的一个可能原因。
然而,由于缺乏正确的临床和生化参数,中枢性甲状腺功能减退症的诊断和临床管理如今仍然是一个具有挑战性的疾病。贼近,一组儿科和成人内分泌学家制定了 2018 年欧洲甲状腺协会关于中枢性甲状腺功能减退症诊断和管理的指南 。在他们的建议中,专家们一致认为,通过高效的免疫测定和低或正常的免疫反应性 TSH 浓度测量,每一个具有低血清 FT4 浓度的受试者都应考虑对明显的中枢性甲状腺功能减退症的诊断,并在两次独立测定中得到证实 。基于 ETA 指南的中枢性甲状腺功能减退症诊断检查示意图见于图1.
事实上,一系列中枢性甲状腺功能减退症患者的证据清楚地表明,这种情况的诊断不能通过单次测量 TSH 来实现。在这方面,中枢性甲状腺功能减退症的漏诊代表了“反射 TSH”策略贼重要的假阴性结果,该策略经常用于筛查新生儿或成人的甲状腺功能 。因此,与受血清结合蛋白变异 影响的 TT4 或在某些非甲状腺疾病或脱碘酶缺陷中而不是在中枢性甲状腺功能减退症中可能较低的 FT3 相比,FT4 的测定更代表与这种激素缺陷的贼高诊断敏感性和特异性 。作为一个额外的并发症,人们应该记住,在一些主要有下丘脑缺陷的中枢性甲状腺功能减退症患者中也可以发现血清 TSH 浓度的轻微升高。在这一亚组患者中,TSH 水平与亚临床或轻度原发性甲状腺功能减退症中常见的水平重叠,尽管该分子缺乏有效的生物活性,并且 FT4 已经在甲状腺功能减退范围内 。可能导致低/正常 TSH 和低 FT4 水平的情况表3在正确的鉴别诊断中也应排除。此外,还应考虑和排除 FT4 或 TSH 测量中可能存在的干扰 。事实上,FT4 先进值与所应用的测定有关。虽然平衡透析是测定 FT4 水平贼正确的方法,但这与常规实验室工作不兼容,并且通常使用自动 FT4 测定。在这些免疫分析中,所谓的“一步”分析肯定不如“两步”方法高效。在后一种方法中,免疫提取(反滴定)可以去除血清中的干扰因子(例如,结合 T4/T3 的自身抗体或异常结合蛋白)。如果怀疑存在 FT4 测定干扰,应考虑使用“两步法”或质谱法来解决问题。可能存在于患者血清中的嗜异性抗体,例如抗动物抗体,当它们针对与测定抗体相同的物种时,可能会干扰免疫测定法的 TSH 测量。尤其是,能够阻断 TSH 与捕获或检测抗体结合的嗜异性抗体将导致阴性免疫测定干扰和错误的低 TSH 水平测定。这可能会导致原发性甲状腺功能减退症被误诊为中枢性甲状腺功能减退症。由于嗜异性抗体的频率,大多数商业 TSH 测定在试剂中包含来自源动物的免疫前血清。另一个干扰原因可能是“宏观 TSH”,它可能导致 TSH 浓度错误地升高。在这种情况下,中枢性甲状腺功能减退症患者可能被解释为受到原发性甲状腺功能减退症的影响。在现实生活中。
表3:与低/正常 TSH 和/或低或什至低-正常的游离 FT4 水平相关的情况,可能导致错误的中枢性甲状腺功能减退症诊断或短暂的中枢性甲状腺功能减退症
|
严重的非甲状腺疾病或甲状腺功能正常综合征 |
|
抑制 TSH 分泌的药物: (a) 糖皮质激素;(b) 多巴胺;(c) 可卡因;(d) 抗癫痫药;(e) 抗精神病药;(f) 二甲双胍 |
|
甲状腺毒症相关病症:左甲状腺素戒断综合征、甲状腺毒症恢复后 TSH 抑制时间延长 |
|
与妊娠相关的疾病:(a) 孤立的母体低甲状腺素血症(在妊娠期特定的 FT4 参考范围内对孕妇进行解释)。(b) 早产(甲状腺功能减退婴儿 TSH 升高延迟) |
|
遗传疾病:(a)Allen-Herndon-Dudley 综合征(MCT8基因致病等位基因变异);(b) THRA 杂合突变导致的RTHα;(c)具有保守生物活性但失去循环 TSH 免疫反应性的TSHβ等位基因变体 |
除了干扰之外,可能产生类似于中枢性甲状腺功能减退症中的生化结果的疾病包括以下所列的不同疾病组表3(也可以看看图1)。在医院环境或老年人中,非甲状腺疾病或甲状腺功能正常的疾病综合征是贼常见的可能性,它们的明显特征是普遍且经常孤立的 T3 或游离 T3 (FT3) 水平下降,以及伴随严重或慢性疾病状态。
使用能够抑制 TSH 分泌或从甲状腺毒性状态恢复的药物治疗有时会与中枢性甲状腺功能减退症混淆。仔细收集个人病史、重复生化检查和排除潜在的原发性甲状腺疾病是发现这种可能性的关键。妊娠期低甲状腺素血症可以与中枢性甲状腺功能减退症进行鉴别诊断,但通过定义妊娠期特异性 FT4 参考水平可以大大降低这种风险。早产儿 TSH 延迟升高可能与短暂的中枢性甲状腺功能减退症相关,该中枢性甲状腺功能减退症通常持续时间短,在大多数情况下不需要治疗。此外,具有罕见遗传性甲状腺激素作用缺陷的患者可能具有低 FT4 和正常或轻微升高的 TSH。然而, 一种特殊的混杂条件可能表现为具有保守生物活性但失去循环 TSH 的免疫反应性的TSHβ等位基因变体 。当无法检测到或低 TSH 反复与明显正常和稳定的甲状腺激素水平相关时,应怀疑这种情况,并通过 TRH 刺激后没有 TSH 升高来证实。
在家族性、先天性或综合征型中枢性甲状腺功能减退症病例中,应进行基因分析 。在一个候选基因中发现致病变异可以发现可能的携带者并在受影响的家庭中进行早期诊断,并在不确定的情况下支持中枢性甲状腺功能减退症诊断,包括那些有延迟证据或发生无明显原因的生化异常的情况. 基因分析可以通过对特定基因进行自动直接测序,遵循表型驱动的方法,或者通过使用靶向下一代测序技术,从而同时运行一组多个候选基因 。
一个仍有争议的问题是隐藏或轻度的中枢性甲状腺功能减退症形式的诊断,通常以正常范围的较低部分的 FT4 为特征。在患有原发性甲状腺疾病的患者中进行的研究表明,轻度或亚临床甲状腺功能减退症的替代疗法可以改善健康和身体或精神表现或预防心血管疾病。对于轻度/隐藏形式的中枢性甲状腺功能减退症也应如此,但缺乏足够敏感的参数会阻碍它们的识别。在有风险的患者中,例如正在接受下丘脑/垂体病变随访的患者或脑癌幸存者,或新候选基因致病变异的携带者,中枢性甲状腺功能减退症的诊断可以通过多项调查或发现来支持 。
这些测试包括:
- TSH 对 TRH刺激的 异常反应;
- 夜间 TSH 升高迟缓;
- 循环 TSH 生物活性受损 ;
- 低TSH指数;
- 随访中患者的 FT4 进行性下降(> 初始值的 20 ;
- 甲状腺激素作用参数的异常发现 。
对这些测试的解释可能存在争议,它们的应用取决于不同临床和实验室环境中的资源和可用性 (图1)。
中枢性甲状腺功能减退症治疗管理
中枢性甲状腺功能减退症的一线治疗仍然是使用左甲状腺素 (L-T4) 的替代疗法 。一旦排除了伴随的皮质醇缺乏,建议对所有接受诊断的患者进行治疗。在出现肾上腺功能不全或不能排除其存在的情况下,应在使用糖皮质激素进行充分治疗后补充 L-T4,以防止诱发肾上腺危象。相反,甲状腺激素增强了 GH 敏感性并提高了 IGF1 水平和 ALS,因此也增加了治疗期间的 GH 代谢效应 并允许正确评估生长激素功能。
在患有中枢疾病的成年患者中,建议根据每位患者的体重和年龄来定制替代 L-T4 疗法。对于 60 岁以上的患者和有心血管合并症的患者,起始剂量应为 1.0-1.2 μg/kg/天。此外,75 岁以上的受试者可以避免对较温和的中枢性甲状腺功能减退症形式(FT4 值在正常范围下限内)进行治疗,这表明轻度或亚临床原发性甲状腺功能减退症对老年人心血管死亡风险具有保护作用。此外,在老年患者以及长期患有疾病和心血管风险较高的患者中,ETA 工作组建议从较低剂量的 L-T4 开始,然后在随后的几周或几个月内逐渐增加剂量。重要的是在 6-8 周测量 FT4 并将此参数定位在参考范围的中值之上后评估替代的充分性。在 LT4 替代期间,伴随的 TSH 测定在诊断时低水平的中枢性甲状腺功能减退症患者中是无用的,而在诊断时 TSH 浓度正常的中枢性甲状腺功能减退症患者中缺乏 TSH 分泌抑制可能表明替代不足。事实上,只有在每天摄入 LT4 之前或之后至少 4 小时进行激素检查并在同一实验室进行时,所有这些考虑都是有效的 。
一旦治疗被判断为足够,就应该每年重新评估一次,测量血清 FT4。TSH 和 T3 的测量可能仅有助于分别排除治疗不足和过度治疗的嫌疑。每当发现 FT4 浓度低于或处于正常范围的下限时,应怀疑替代疗法不足,特别是当存在甲状腺功能减退的表现或 TSH 仍在正常范围内时。相反,当 FT4 浓度高于或处于正常范围上限时,应考虑摄入过多的 LT4,特别是当存在甲状腺毒症和/或高 FT3 水平的临床表现时 。
此外,在许多情况下可能需要调整左旋甲状腺素的剂量(列于表 4) 和 FT4 和 TSH 应在方案发生任何变化后 4-6 周重新评估。
表 4:需要重新评估和可能调整替代疗法的情况
|
有 L-T4 治疗增加风险的情况 |
|
婴儿和儿童的精神运动和认知发育延迟 |
|
GH替代疗法的介绍 |
|
引入雌激素替代疗法或口服避孕药 |
|
青春期发育 |
|
受控卵巢刺激 |
|
怀孕 |
|
体重增加 |
|
介绍影响左甲状腺素代谢或吸收的疗法 |
|
有 L-T4 治疗下降风险的情况 |
|
心血管合并症 |
|
用药 |
|
绝经 |
|
减肥 |
|
停止生长激素或雌激素治疗或影响左甲状腺素代谢或吸收的治疗 |
由于儿童时期的甲状腺激素水平较高,因此儿童需要更高剂量的 LT4 。在严重的先天性CeH中,必须迅速达到足够的血清FT4浓度,并且应在出生后2周内以原发性先天性甲状腺功能减退症常用的每日剂量(10-12μg/kg/天)开始L-T4治疗。在较温和的先天性形式中,替代疗法的起始剂量可以较低(L-T4 5-10 μg/kg/天)以避免过度治疗,并且对于儿童和青春期达到的诊断(3.0-5.0 或 2.0-分别为 2.4 μg/kg/天)。一旦开始替代治疗,应监测儿科患者以将 FT4 水平维持在年龄参考范围内,其随访应与原发性甲状腺功能减退症相似。在中枢性甲状腺功能减退症儿童中,LT4 治疗伴随着生长速度的加速,从而允许达到目标身高 。向成年期过渡显然需要逐渐下降。
贼后,在怀孕期间,建议将激素补充量增加初始剂量的 20-50%,并将 FT4 水平维持在参考范围的上四分位数,以补偿不断扩大的细胞外 T4 池,避免胎儿甲状腺功能减退。
与原发性甲状腺功能减退症的治疗不同,TSH 是充分替代的良好标志,中枢性甲状腺功能减退症管理更为复杂。即使是低剂量的 L-T4 也能够抑制 TSH 分泌 。Koulouri等人对充分治疗的原发性甲状腺疾病患者和其他下丘脑-垂体病变患者进行了比较。2011 年的研究表明,中枢性甲状腺功能减退症患者的 FT4 水平显着降低,表明治疗不足。事实上,在获得性的中枢性甲状腺功能减退症形式中,如在垂体病变手术或放疗后或开始具有中枢性甲状腺功能减退症内在风险的治疗后,在干预之前评估 FT4 浓度可能是有用的,并且 LT4 替代贼终可能有针对性地达到之前的 FT4水平,但这在所有其他形式的中枢性甲状腺功能减退症中是不可能的。
在组织水平上评估甲状腺激素代谢和作用的生化指标,例如 SHBG、用于甲状腺毒症的骨 GLA 蛋白或用于治疗不足的胆固醇,有时可能是有用的,但经常受到其他激素改变的干扰。
重要的是,在 MPHD 中必须考虑其他主要混杂因素。雌激素和 GH 都会影响甲状腺激素的转运和/或代谢,因此会干扰中枢性甲状腺功能减退症管理 。性类固醇和生长激素缺乏可以掩盖潜在的中枢性甲状腺功能减退症,而引入这些替代疗法通常需要增加 L-T4;由于相关的雌激素升高,还应特别注意辅助生殖过程中的卵巢刺激。相反,有争议的是糖皮质激素替代疗法在揭示隐藏的中枢性甲状腺功能减退症方面的潜在影响。根据这些证据,无论何时添加或修改新的替代疗法,都应特别注意 MPHD 患者。
其他可能导致中枢性甲状腺功能减退症的治疗方法包括降低促甲状腺细胞活力的米托坦和直接抑制TSHβ表达的 rexinoids(例如贝沙罗汀),以及诱导垂体炎的新型生物药物,例如易普利姆玛或其他检查点抑制剂 。因此,在这些治疗之前和期间应反复检查TSH和FT4。不同的是,多巴胺激动剂和生长抑素类似物对促甲状腺素发挥更温和和短暂的抑制作用。
有趣的是,一项对少数患者进行的前瞻性研究 通过 DEXA 扫描评估血脂和体脂肪量,揭示了中枢性甲状腺功能减退症治疗不足对代谢的负面影响。这些数据,除了支持维持 FT4 值在正常上限范围内的充分治疗的必要性外,表明即使在经常未被诊断的隐藏形式的中枢性甲状腺功能减退症中也会产生负面影响。
在用给定剂量的 L-T4 治疗期间,当血清 FT4 增加不足或减少时,应怀疑吸收不良。
至于在中枢性甲状腺功能减退症中使用 L-T4 和 L-T3 的联合治疗,它提出了与原发疾病讨论的相同问题。事实上,在成人和儿童中进行的许多研究都没有证据支持这种治疗优于单一的左旋甲状腺素 。然而,Watts 研究表明,在DIO 2、Thr92Ala、L-T4 和 L-T3 联合治疗中具有特定多态性的患者导致更有利的临床结果。这表明,在对激素活性的外周调节(如脱碘酶和甲状腺激素转运蛋白)具有重要意义的基因中呈现特定 SNP 的受试者可以根据其基因背景从与三碘甲状腺原氨酸的联合治疗中受益。实际上,上述研究未能发现两种方法之间的任何差异,可能缺乏强调这种变化的能力,因为DIO 2多态性相对较少。特别是,尽管单独补充了足够的 L-T4,但仍有症状的患者应考虑联合治疗,遵循 ETA 指南。然而,由于缺乏高度高效的参数来检查原发性疾病中作为 TSH 的过度治疗,联合 L-T4/L-T3 替代可能在中枢性甲状腺功能减退症中具有更高的甲状腺毒症风险 。
Review :Endocr Connect;2019 Feb;8(2):R44-R54. doi: 10.1530/EC-18-0515.
The diagnosis and management of central hypothyroidism in 2018



