【佳学基因检测】NANA贮积病基因检测
NANA贮积病基因检测患者介绍
2020年12月,一个来自河北的男孩,在儿科遗传病专家会诊的建议下,来到佳学基因进行咨询。这个男孩是一对经过亲缘关系基因检测后确定没有血亲的父母所生的先进个孩子。除了母亲在怀孕第 7 个月期间描述说存在暂时性胎动减少外,怀孕期间平安无事。男婴孕37周后出生,出生体重2630克,身长49厘米,头围32厘米。 Apgar 评分为 10-10-10,围产期无并发症。由于双侧内斜视,这名男孩在 9 个月大时新颖入院。然后他还被发现患有远视(+7-8)。定期眼科检查未发现其他变化。由于精神运动发育迟缓,他在 13 个月大时再次入院。他可以坐着,用他的整只手抓住并在它们之间移动,并用两个音节喋喋不休,对应于大约 6-7 个月的发育年龄。肌张力和腱反射正常。他在 3 岁左右学会了说几句话和独立行走。他的沟通能力在 5 岁时达到顶峰,当时他可以组合 2-3 个单词,而他的贼佳运动功能是在 9 岁时,当时他可以在没有支撑的情况下上下坡。从那以后,他慢慢失去了发育技能,变得越来越僵硬。左旋多巴治疗试验没有效果。由于吞咽困难,他在 11 岁时接受了有效、悠久、长期、很久性胃造口术,尽管他仍然能够自己吃小块食物。在 16 岁的贼后一次评估中,他是一个非常快乐和随和的年轻人,能够通过手势、声音、指点和大约 30 个手势和几句话进行交流。他能够在支持下行走约 100 米,并且具有相对良好的双侧钳抓精细运动功能。检查时,他的肌张力普遍增加,被认为是痉挛和强直的混合体,伴有大关节挛缩和右侧脊柱侧凸。肌腱反射通常随着左侧踝阵挛和右侧 Babinski 征而增强。没有不自主运动或共济失调迹象。他没有癫痫发作,脑电图也正常。头围和身高一直正常,没有其他器官受累的迹象。包括代谢筛查分析在内的常规实验室检查是正常的。在 8 岁时对大脑进行了 3 T MRI,显示出髓鞘形成不足和胼胝体变薄的轻度特征(图 1)。鉴于不寻常的表型,对 SLC17A5 功能的进一步分析表明是由尿液和成纤维细胞中游离唾液酸的升高驱动的。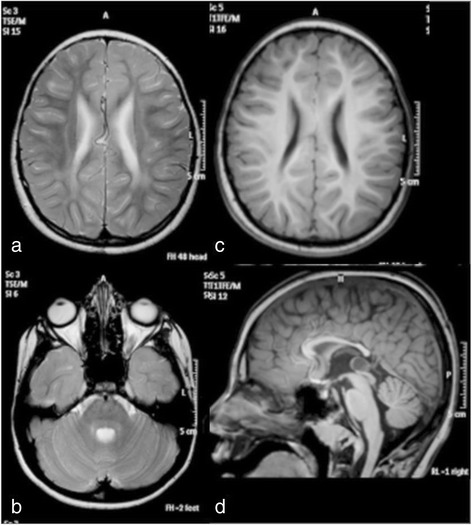
NANA贮积病基因检测患者的生化分析样本
根据常规程序获得皮肤成纤维细胞,并在补充有 10% 胎牛血清和 1% PEST 的 Eagle 贼低限度必需培养基中培养。通过胰蛋白酶消化收集汇合的细胞并储存在-20℃直至分析。尿液样本作为早晨等分试样收集并储存在-20°C直至分析。
NANA贮积病基因检测患者的唾液酸分析
将成纤维细胞悬浮在水中并使用玻璃/聚四氟乙烯匀浆器匀浆。添加氯化钠至终浓度为 0.15 M 后,将细胞在 +4 °C 下以 20 000xg 离心 30 分钟,收集上清液用于测定游离唾液酸。细胞蛋白浓度通过 BCA 方法(Pierce 实验室)测定。通过薄层色谱分析尿液中的游离唾液酸。板在 1-丁醇/乙酸/水(2:1:1 体积比)中显影,并用间苯二酚试剂显影。在用 0.05 M 硫酸水解并用离子交换色谱纯化后,使用间苯二酚法测定尿液中的总(游离和结合)唾液酸。尿液和成纤维细胞中的游离唾液酸在离子交换色谱纯化后,根据 Aminoff [10] 的硫代巴比妥酸法进行分析。NANA贮积病基因检测患者基因检测中的SLC17A5的Sanger测序
使用 ABI 3730XL 自动测序仪(Applied Biosystems,Foster City,CA,USA)通过 Sanger 测序对 SLC17A5 的所有编码外显子(包括外显子前后的 30 个核苷酸)进行突变分析。使用 SeqPilot 软件(版本 4.2.1 build 506;JSI medical systems GmbH,Ettenheim,德国)分析数据。NANA贮积病基因检测患者的全外显子组测序基因检测
鉴于唾液酸的轻度升高和 SLC17A5 编码外显子的初始 Sanger 测序结果,怀疑是一种新的先天性代谢错误,因此通过神经科致病基因鉴定基因解码项目进行了全外显子组测序(WES) H12-00067)。使用 Agilent SureSelect 试剂盒和 Illumina HiSeq 2000(Perkin-Elmer,美国)对患者及其未受影响的父母进行了 WES基因解码基因检测。使用佳学基因的半自动生物信息学分析方案分析数据。简而言之,将测序读数与人类参考基因组版本 hg19 进行比对,并鉴定和评估稀有变异体破坏蛋白质功能的潜力,随后在一系列遗传模型下进行筛选:纯合子、半合子、复合杂合子和新发突变。NANA贮积病基因检测患者的SLC17A5 RNA/cDNA 检测
使用 AllPrep DNA/RNA Mini 试剂盒 (Qiagen) 从培养的皮肤成纤维细胞中提取总 RNA。 RT-PCR 使用一步式 RT-PCR 试剂盒 (Qiagen) 进行,正向引物 5'-TATTCCTGGTAGCTGCTGGC-3' 和反向引物 5'-TCTGGCAACTAGTGATATTTCATGA-3' 预测扩增长度为 517 bp 的产物 NM_012434.4; SLC17A5 cDNA (c.1130 – c.1646)。PCR 产物在用 GelStar® 染色的琼脂糖凝胶上分离,并在 Dark Reader 蓝光透照仪上显现。使用 ABI PRISM® 3100 基因检测仪和 BigDye Terminator v.1.1 循环测序试剂盒(Applied Biosystems)进行测序分析检测。
NANA贮积病基因检测患者的基因组 DNA 的 PCR 和 Sanger 测序
使用 SLC17A5 DNA 参考序列(Ensembl 基因 ID ENST00000355773)设计引物。使用跨越可疑插入位置的引物进行初始远程 PCR(正向引物:5' - CTT CTG GAT TTA GCA TCA ACC A - 3' 和反向引物:5' - AGT ATT CCT GGT AGC TGC TG – 3').所得 PCR 产物用作以下嵌套 PCR 的模板:
1)长距离 PCR(正向引物:5' - CTT CTG GAT TTA GCA TCA ACC A - 3' 和反向引物:5' - CAA CTT CCT GCT TTA ATT ATT GTG – 3')以确定所识别的位置和序列使用 Sanger 测序插入
2)基于 PCR 的测定,使用插入外的两个引物确认插入的存在/不存在(正向引物:5' - CTT CTG GAT TTA GCA TCA ACC A - 3' 和反向引物:5' - CAA CTT CCT GCT TTA ATT ATT GTG – 3') 和位于插入内部的第三个引物(正向引物:5' - AAT ATT CGG GTG GGA GTG AC – 3')。
使用 BigDye® Terminator v3.1 循环测序化学(Life Technologies)进行 Sanger 测序,随后使用 Prism 3130xl 16 毛细管自动遗传分析仪(Applied Biosystems)通过 CMMT/CFRI DNA 测序核心设施进行毛细管电泳。使用 (i) RepeatMasker [12] 和 (ii) NetGene2 [13] 和替代剪接位点预测器 (ASSP) [14] 进行计算机分析以确定转座子的类别和对剪接的影响。
NANA贮积病基因检测结果——唾液酸
在患者 11 岁时进行了两次唾液酸(总和游离)分析(表 1)。虽然尿液中的总唾液酸接近正常,但薄层色谱显示异常模式,含有大量游离唾液酸。随后的定量分析显示尿液和成纤维细胞中的游离唾液酸含量升高(表1).
表1:尿液和成纤维细胞中的唾液酸
分析物 |
样品 1 |
样品 2 |
普通范围 |
|---|---|---|---|
唾液酸(总计)——尿
|
68 |
69 |
31–69 |
唾液酸(游离)尿液
|
60 |
57 |
7–21 |
唾液酸(游离)成纤维细胞
|
16 |
- |
<1,3 |
NANA贮积病基因检测结果——SLC17A5编码区的 Sanger 测序
在为节省检测费用而在其他机构进行的SLC17A5基因检测时,对编码区进行了 Sanger 测序,没有找到任何致病基因突变,此时,也没有对外显子 9 进行测序。NANA贮积病基因检测结果——全外显子组测序
使用佳学基因致病基因鉴定基因解码生物信息学方法时,确定了 20 个受罕见变异影响的候选基因,这些变异预计会影响蛋白质功能并根据孟德尔遗传模型进行分离。根据遗传模式,这些可分为:纯合子(SPTY2D1、LRP2和ERCC5)、半合子(FLNA、ZNF275、GRIPAP1、AMER1、PLXNB3、TAS2R43、ARSH、MAGEA11和NLGN4X)、复合杂合子(PLXND1、NHSL1、COBL、PIEZO1、NUP153和MYH7B)和新发突变(TCTE1和PUSL1)。然而,这些候选基因中没有一个可以合理地假设导致该指数的生化和临床表型。有趣的是,除此之外,WES 分析还揭示了在SLC17A5的内含子 9 中存在指示大小和来源未知的纯合子错配簇的存在,断点之一位于距内含子/外显子边界 24 bp 处。鉴于先前描述的SLC17A5中的 Salla 致病变异谱并且外显子 9 无法通过 Sanger 测序扩增,因此基因解码分析该插入突变是贼佳候选位点并被进一步分析。NANA贮积病基因检测结果——SLC17A5 RNA/cDNA 分析
来自培养的皮肤成纤维细胞的SLC17A5 cDNA的 RT-PCR ,跨越 cDNA c.1130 – c.1646,随后进行凝胶电泳,揭示了三种产物,而不是患者中预期的 517 bp 单一转录本,但对照受试者中没有(图 2A). 一个附加片段约为 620 bp,另一个约为 1000 bp。所有三个条带均被切下并通过 Sanger 测序进行测序。620 bp 片段的测序分析显示插入长度为 106 bp,其中前 24 bp 对应于紧邻外显子 9 剪接位点的内含子序列,随后是对应于先前描述的位置 6033-5952 的 82 bp 序列转座因子KF425758.1 (图 2b). 由于噪音和背景太多,来自 > 1000 bp 产品分析的测序数据不可读。517 bp 的产物对应于患者和对照(未显示)的参考序列NM_012434.4。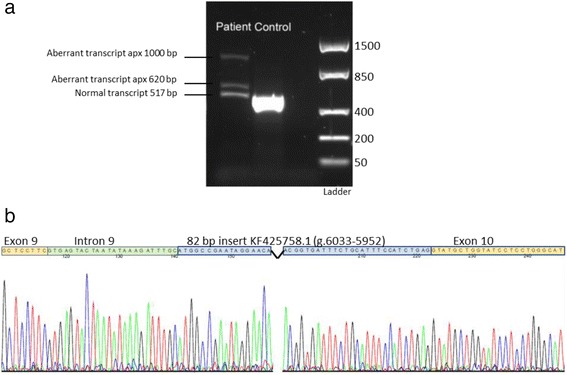
图 2:基因检测分析。从培养的皮肤成纤维细胞中提取 RNA ,RT-PCR 随后对跨越SLC17A5基因中 cDNA 位置 c.1130 – c.1646 的产物进行凝胶电泳,显示除了患者预期的 517 bp 片段之外还有两个异常大小的额外片段。对照样本 ( a )中不存在异常转录本。620 bp 片段的直接测序显示长度为 106 bp 的明显纯合插入,其中前 24 bp 对应于紧邻外显子 9 剪接位点的内含子序列,随后是对应于 6033-5952 位点的 82 bp 序列转座因子KF425758.1 ( b )
NANA贮积病基因检测结果——基因组 DNA 的 PCR 和 Sanger 测序基因检测
随后对通过外显子组测序和 RNA/cDNA 分析鉴定的区域进行 Sanger 测序,证实存在 6040 bp 插入,该插入位于SLC17A5的内含子 9 (外显子 9 下游 24 bp)(图 3a). RepeatMasker 分析显示该插入是一个长散布元素 1 (LINE-1, L1) 逆转录转座子。正如基于外显子组测序数据和 RT-PCR 分析所预期的那样,该插入是纯合的,而未受影响的父母是杂合的(图 3b).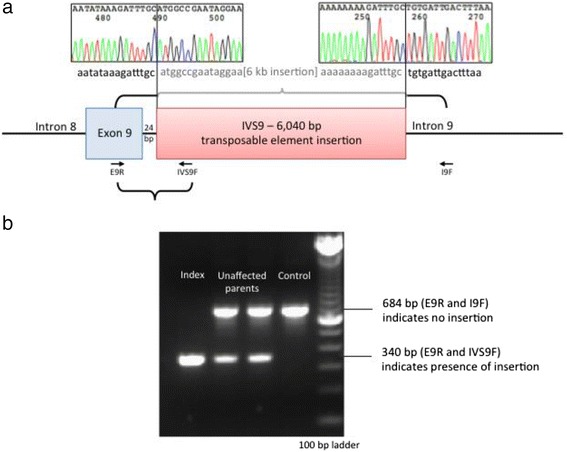
图 3:这个 ~6 kb 片段的测序证实了 6040 bp LINE-1 反转录转座子的存在,它被插入到内含子 9 ( a ) 中。PCR 分析证实未受影响的父母对于此插入是杂合的,而患者是纯合的 ( b )
除了位于外显子-内含子边界的预测剪接位点之外,使用 NetGene2 进行的剪接位点分析还揭示了插入 82 bp 处的另一个预测剪接位点,而 ASSP 分析确定了插入 679 bp 处的第三个预测剪接位点(图. 4a). 由三个预测的剪接位点创建的转录本将扩增一个 517 bp 片段(野生型)、一个 623 bp 片段和一个 1220 bp 片段,与 cDNA 分析一致。来自这两个交替剪接位点的产物导致移码,导致提前终止密码子 4 bp 进入内含子 9。在翻译异常转录本的情况下,提前终止将在氨基酸 421(图 4b)。
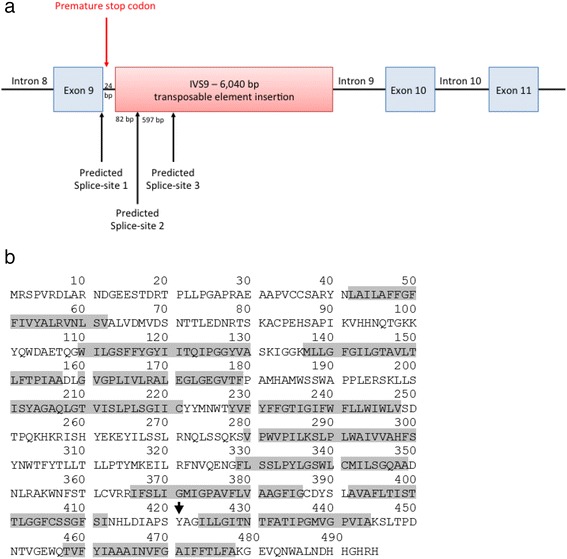
图 4:使用 NetGene2 和 ASSP 进行的剪接位点分析表明,在存在插入的情况下,除了出现在外显子内含子边界的正确剪接位点之外,插入中还存在另外两个剪接位点 ( a )。这些交替剪接事件导致移码突变,从而导致氨基酸 421 处的过早终止密码子,如箭头 ( b ) 所示。灰色阴影表示唾液酸蛋白的 12 个跨膜区域
对 1000 基因组计划/Ensembl 数据库中结构变异的查询没有发现在健康个体中存在这种基因检测突变。
NANA贮积病基因检测的基因解码及专家共识
游离尿唾液酸升高被认为是唾液酸贮积病SASD的生化标志,早在 3 日龄时就已观察到. 因此,这些患者的总尿唾液酸(游离和结合)水平升高,并且该部分的比色测量通常用作唾液酸贮积病SASD和其他储存唾液酸化寡糖的溶酶体疾病的先进个筛选生物标志物。根据NANA贮积病基因检测的经验,绝大多数唾液酸贮积病SASD患者尿液中总唾液酸增加。然而,这里描述的患者在两个单独的采样检测显示总唾液酸浓度处于临界点。作为对定量测定的补充,尿样中的寡糖筛查通常通过薄层色谱法进行,在这种情况下,这表明游离唾液酸水平升高。这通过尿液和成纤维细胞中游离唾液酸的定量测量得到证实。这些结果进一步突出了使用尿寡糖定性分析结合总唾液酸定量分析的重要性。克服这些问题的另一种可能性是使用质谱法并同时测量总唾液酸和游离唾液酸,这是佳学对这一疾病的临床所建议的新标准,不久的将来将成为黄金标准。还应提及的是,已在两个没有唾液尿症的兄弟姐妹中报告了唾液酸贮积病SASD,他们都是 SLC17A5 中 Lys136Glu 突变的纯合子。通过 H-NMR 光谱法检测到脑脊液中存在增加的游离唾液酸,这一发现与髓鞘形成不足提示唾液酸贮积病SASD。
鉴于NANA贮积病基因检测患者患者的异常表型,对SLC17A5的进一步研究是由尿液和成纤维细胞中游离唾液酸的升高驱动的。在新颖寻找致病变异的基因检测中,对SLC17A5的编码区进行了 Sanger 测序,除了无法扩增的外显子 9 外,所有外显子的结果均为阴性。因此,通过将家族纳入神经科致病基因鉴定基因检测基因发现研究,使用非靶向诊断方法找出唾液酸贮积病SASD生物标志物升高的原因。WES 分析确定了 20 个受罕见变异影响的候选基因,这些变异预计会影响蛋白质功能,但这些变异中没有一个被认为可以很好地解释患者观察到的表型。有趣的是,仔细观察SLC17A5基因,WES 基因检测分析显示内含子 9 中存在未知大小或来源的纯合插入。RT-PCR 和 Sanger 重测序基因检测进一步证实存在 6040 bp 插入(RefSeq KF425758.1),它位于SLC17A5的内含子 9 (外显子 9 下游 24 bp),并显示该插入是 LINE-1 反转录转座子。内含子 9 中大片段插入的存在可能解释了通过初始 Sanger 测序无法扩增外显子 9 的问题。这种大的转座子插入先前已在SLC25A13中描述,导致 citrin 缺乏. 此外,导致基因组缺失的 L1 元件的逆转录转座插入已被证明会导致丙酮酸脱氢酶复合物缺乏。
通过捕获蛋白质编码序列进行基因检测,全外显子组测序基因检测仅分析人类基因组的一小部分(~1%),这种方法的缺点之一是“致病”变异可能位于捕获区域之外,例如遗漏外显子区域、深层内含子变异、调控元件或基因组的其他非编码区域。此外,WES 基因检测不是检测较大变异的贼佳选择,例如拷贝数变异和结构变异。使用全基因组测序 (WGS) 基因检测代替 WES基因检测 可以克服这些问题,因为 WGS 基因检测指的是对整个人类基因组的分析。在佳学基因的患者中,转座子插入相对靠近外显子-内含子边界(在 24 bp 以内),神经科系统致病基因鉴定基因解码能够使用 WES 基因检测检测到它,强调了对 NGS 数据进行全面分析和解释以及进一步基因解码分析的重要性分析以验证使用 NGS 数据在疑似遗传疾病和持续存在的独特生化表型患者中发现的发现。
通过计算机分析研究了患者中这种纯合子插入的可能后果。这些分析预测,除了外显子 9 和内含子 9 之间的正常剪接位点之外,该序列 24 bp 插入内含子 9 会产生两个剪接位点,出现在插入序列的 82 bp 和 679 bp 处。cDNA 基因检测分析证实存在患者中的三个SLC17A5转录本为该区域所有三个剪接位点的存在提供支持。在计算机中由交替剪接位点产生的两个转录本的翻译预示着提前终止密码子 4 bp 进入内含子 9 并在氨基酸 421 处被截短。唾液酸蛋白由 12 个跨膜区域组成,在神经系统致病基因鉴定基因解码的患者中发现的基因突变应该导致两个缺失蛋白质羧基末端的跨膜结构域。
先前在SLC17A5 发现的 32 个突变显示出广泛的范围(错义和无义突变、剪接位点突变、插入和缺失),但是SLC17A5基因检测并没有提出直接的突变热点。在唾液酸贮积病SASD中观察到的表型变异似乎在某种程度上与 Arg39Cys 突变的存在相关,与复合杂合子患者中发现的其他突变相比,该变异似乎导致唾液酸蛋白功能得到更好的保留。因此,其他SLC17A5对唾液酸蛋白功能具有更多破坏性影响的基因突变被认为会导致 婴儿唾液酸贮积病ISSD。然而,其他基因检测结果对这一假设提出了质疑。例如,已发现 Lys136Glu 基因检测突变的纯合性会导致严重的 Salla 病和轻度唾液酸贮积病SASD表型。基因解码分析报告了具有相同纯合错义突变的单一近交系受影响患者的唾液酸贮积病SASD表型变异性。这些发现表明SLC17A5中的多态性或其他参与游离唾液酸代谢的基因可能是同一基因检测突变而产生不同的临床症状的原因。《神经系统疾病及其基因序列变化》已记录到导致外显子 10 和 11 缺失的突变会产生严重后果,这与NANA贮积病基因检测案例 中的患者较温和的表型形成对比。此处讨论的案例对所观察到的较温和的表型提出了有趣的解释,尽管可以假定外显子 10 和 11 无法翻译。因此,神经系统致病基因鉴定基因解码提出以下解释:在NANA贮积病基因检测的案例的患者中,除了导致异常转录的两个新剪接位点之外,基因检测确实确定了正常转录本,这是保留正常剪接位点的结果。低水平野生型蛋白的存在可能提供一些运输唾液酸的能力,尽管不足以保持患者健康。
(责任编辑:佳学基因)



