【佳学基因检测12期】靶向肿瘤细胞周期蛋白的药物病理生理环境
靶向药物基因检测导读
帕博西尼、瑞博西尼 和 玻玛西尼 属于第三代细胞周期蛋白依赖性激酶抑制剂 (CDKis),是晚期和转移性乳腺癌的既定治疗类别。据报道,CDKis 的治疗反应存在个体差异,一些个体可能会出现毒性增加和意外毒性。这篇叙述性综述旨在确定可能导致这种可变性的因素,以推动在临床中最合适和量身定制的 CDKis 使用。具体而言,伴随用药、药物遗传学特征和病理生理条件可能影响吸收、分布、代谢和消除药代动力学。
关键词:
细胞周期蛋白依赖性激酶抑制剂,乳腺癌,个体化医疗
一、细胞周期蛋白依赖性激酶抑制剂靶向药物介绍
由细胞周期蛋白和细胞周期蛋白依赖性激酶 (CDK) 组成的复合物是细胞周期进程中的关键检查点,并且已证明该途径上的一些突变与癌症有关。在乳腺癌中,CDK4 和 CDK6 抑制剂 (CDKis) 已成为通过不同途径进行细胞增殖的关键参与者。CDKis的作用机制如图所示图1.
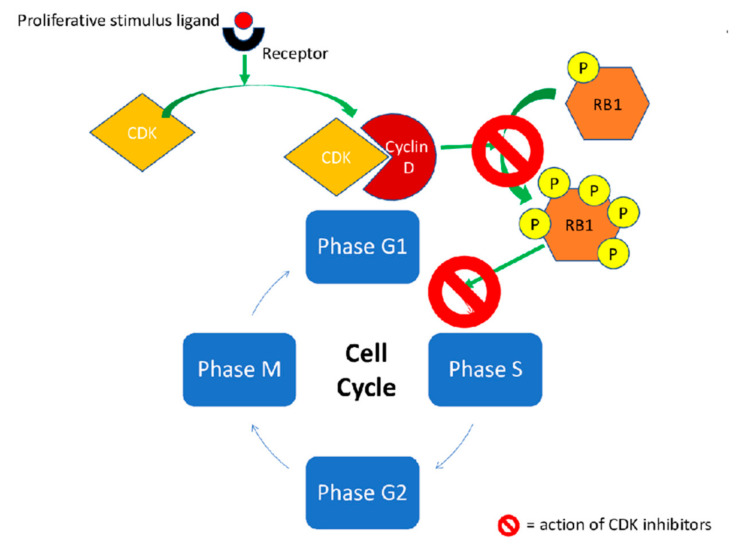
图1:基因检测后靶向肿瘤细胞周期蛋白依赖性激酶的靶向药物的作用机理(Int J Mol Sci. 2020 Sep; 21(17): 6350.)
红色显示了 CDK 抑制剂阻止的酶促反应。生理上,生长信号诱导结合 CDK4 或 CDK6 的 Cyclin D 的表达;这种 CDK-Cyclin 复合物促进与 E2F 转录因子结合的肿瘤抑制蛋白 RB1 的过度磷酸化,从而决定其释放以及与细胞进入 S 期和增殖有关的基因的随后表达,如拓扑异构酶-IIα。Cyclin D 的过度表达表现在过度激活的细胞信号传导中,参与了几种肿瘤的肿瘤发生,如 RAS/RAF/MEK/ERK 和 PI3K/AKT/mTOR 通路。当使用 CDK 抑制剂时,复合 CDK-Cyclin D 对 RB1 的过度磷酸化以及随后允许细胞周期从 G1 期过渡到 S 期的重要酶的转录,例如拓扑异构酶-Iiα,被阻止。CDK——细胞周期蛋白依赖性激酶;RB1-RB 转录辅阻遏物 1;P——磷酸盐基团。
乳腺癌代表了一种有趣的病理环境,其中 CDKis 构成了当前的治疗工具并提供了最先进的观点,特别是在晚期激素受体 (HR) 阳性(雌激素受体阳性和/或孕激素受体阳性)和人类表皮生长因子方面受体 2 (HER2) 阴性转移性乳腺癌。
EMA 和 FDA 已批准 帕博西尼、瑞博西尼 和 玻玛西尼 与芳香酶抑制剂(阿那曲唑/来曲唑)或氟维司群联合治疗。在这种临床环境中,作为一线治疗的 CDKis 显示无进展生存期 (PFS) 从安慰剂组的 14-16 个月提高到 帕博西尼、瑞博西尼 或 玻玛西尼 实验组的≥25 个月,如他们的研究所示注册试验:分别为 PALOMA-2、MONALEESA-2 和 MONARCH - 3 。在 MONALEESA-7 试验中,瑞博西尼 与卵巢抑制药和他莫昔芬或芳香酶抑制剂在相同环境下对绝经前妇女的疗效相似。然而,监管机构不批准 瑞博西尼 和他莫昔芬的组合,因为与 QT 延长增加有关的安全原因。当 CDKis 用于二线治疗时,由于芳香化酶抑制剂的反复,与单独使用氟维司群相比,它们与氟维司群联用的 PFS 加倍,如 PALOMA-3、MONALEESA-3 和MONARCH - 2 。
FDA 还批准 玻玛西尼 作为单一疗法,用于治疗 HR 阳性、HER2 阴性晚期或转移性乳腺癌成人患者,这些患者在内分泌治疗和转移性环境中的先前化疗后疾病进展。相反,考虑到 MONARCH-1 是一项 II 期单臂开放标签研究,EMA 不批准 玻玛西尼 单药治疗,其特点是研究人群异质,因为纳入标准广泛(在既往内分泌治疗中或之后有进展的女性)并接受过一种或两种化疗方案)。此外,来自 Flatiron Health 数据库的上市后观察数据被用作历史队列来比较 MONARCH-1 数据,但两项研究之间的不同终点使它们无法直接进行比较,并且 EMA 没有评估强有力的临床证据来支持批准玻玛西尼 作为单一疗法。
帕博西尼、瑞博西尼 和 玻玛西尼 具有相同的作用机制,并显示出相似的药代动力学 (PK) 和药效学 (PD) 曲线。尽管如此,需要概述它们的 PK 和 CDKs 异构体选择性的一些差异。它可以解释一些研究中强调的对治疗的不同反应。与注册试验不同,在临床实践中,临床医生应考虑所有可能干扰所研究药物的 PK/PD 和毒理学特性以及与伴随的流行病学、遗传和临床状况相关的因素。在这方面,一项涉及 CDKis 与芳香化酶抑制剂或他莫昔芬联合临床试验的荟萃分析表明,与非亚洲组相比,由亚洲患者组成的亚组中某些不良事件的先进发生率更高。在同一患者的亚组中也发现了显着不同的疗效概况。有人提出这种现象不仅归因于亚洲患者乳腺癌的不同流行病学特征,而且归因于特定的多因素原因。他们特别关注: a) 体型差异,由于这些药物的固定剂量方案,这可能会导致严重问题;b) 饮食,其中大豆的相关摄入会影响药物代谢;c) 涉及肿瘤发生的促炎基因的不同表达;d) 参与 CDKis 吸收、分布、代谢和消除 (ADME) 的酶的遗传背景,正如日本患者 瑞博西尼的较高平均 C max和 AUC 值所暗示的那样在我们看来,后一点表明细胞色素和转运蛋白在影响 CDKis PK 的 ADME 以及因此它们自身的耐受性方面的关键作用。
本综述的目的是讨论 CDKis 与共同给药药物之间可能有意义的临床相互作用(药物-药物相互作用,DDI)、药物遗传学(药物-基因相互作用,DGI)和可能发生在 ADME 各个层面的病理生理状况。CDKis 药理学特征的差异可能会因降低或增加其口服生物利用度、分布和/或毒性而进一步加剧。对于 CDKis III-IV 期试验中未考虑的所有这些方面,我们的目标是关注患者的特征(DDI、DGI 和病理生理状况),以促进这些药物的更个性化使用。
1.1 药效学
帕博西尼、瑞博西尼 和 玻玛西尼 通过两个氢键选择性和可逆地抑制 CDK4/6 与非活性复合物的 ATP 口袋的结合。在酶促测定中,每种化合物在针对 CDK4 或 CDK6 的活性方面表现出不同的效力。帕博西尼 对 CDK4 和 CDK6 显示出相似的活性(CDK4 IC 50 = 11 nmol/L 对比 CDK6 IC 50 = 16 nmol/L),而 CDK4 的 瑞博西尼 效力高于 CDK6(CDK4 IC 50 = 10 nmol/L 对比. CDK6 IC 50 = 39 nmol/L)。玻玛西尼是最有效的抑制剂,尤其是对 CDK4 的抑制剂(CDK4 IC 50 = 2 nmol/L vs. CDK6 IC 50 = 10 nmol/L )。与 帕博西尼 和 瑞博西尼 相比,玻玛西尼 凭借其官能团,在 CDK4/6 ATP 裂隙中实现了更好的空间互补性。除了表现出更高的 CDK4 抑制效力外,当达到更高浓度时,与 帕博西尼 和 瑞博西尼 相比,玻玛西尼 对 CKDs-细胞周期蛋白复合物的选择性最低,因为与其他多余的 CDK 同种型发生了额外的相互作用。表格1) 。_ _ 因此,玻玛西尼 的主要功效作用是针对 CDK4,其次,CDK9 的效力较低,CDK6 的效力更低,CDK6 负责抑制 RB1 磷酸化和 G1 期的细胞周期停滞。
表格1
帕博西尼、瑞博西尼 和 玻玛西尼 靶向的激酶的分子途径。CDKis与各靶激酶的亲和力等级用-任意表示,无亲和力;+,亲和力的存在;++,高亲和力;+++,非常高的亲和力。
| 靶向激酶 | 靶向激酶的病理生理活动 | 帕博西尼 的亲和力 | 瑞博西尼 的亲和力 | 玻玛西尼 的亲和力 |
|---|---|---|---|---|
| CDK1 | 主要参与控制细胞周期从 G2 期向 M 期的转变 | - | - | + |
| CDK2 | 它选择性地协调 S 期的过程,结合 Cyclin E,而不是像其他 CDK 那样结合 Cyclin D | - | - | + |
| CDK4 | 它抑制视网膜母细胞瘤 (RB) 蛋白家族的成员,包括 RB1,并在 G(1)/S 过渡期间调节细胞周期 | ++ | +++ | +++ |
| CDK6 | 它抑制视网膜母细胞瘤 (RB) 蛋白家族的成员,包括 RB1,并在 G(1)/S 过渡期间调节细胞周期 | ++ | ++ | + |
| CDK7 | 它通过磷酸化包含 RNA 聚合酶 II (CTD) 的 C 末端尾部的七肽重复序列来调节转录的起始 | - | - | + |
| CDK9 | 它通过磷酸化包含 RNA 聚合酶 II (CTD) 的 C 末端尾部的七肽重复序列来调节转录的启动子近端停滞的释放 | - | - | ++ |
| GSK3α/β | 它促进促炎性IL-6的合成和致癌基因的表达 | - | - | + |
| CAMKII α/β/γ | 它参与癌细胞的凋亡和自噬 | - | - | + |
| 迪克 | 它调节一些控制细胞周期的蛋白质 | - | - | + |
| PIM蛋白激酶 | 它是一种致癌蛋白,经常在癌症中扩增 | - | - | + |
| HIPK | 它促进 JAK/STAT 信号传导 | - | - | + |
| CAMK 系列 | 它们是在几种癌症类型中过度表达的酶 | - | - | + |
CDK——细胞周期蛋白依赖性激酶;GSK3α/β-糖原合酶激酶3α/β;CAMKII α/β/γ——钙调蛋白依赖性蛋白激酶 II α/β/γ;DYRK——双特异性酪氨酸磷酸化调节激酶;HIPK——同源域相互作用蛋白激酶;CAMK—Ca 2+ /钙调蛋白刺激的蛋白激酶;JAK——Janus 激酶;STAT——信号转导和转录激活剂。
有趣的是,与 帕博西尼 和 瑞博西尼 相比,玻玛西尼 独立于 CDK 途径,呈现出多种作用机制,抑制参与影响细胞增殖、炎症和肿瘤发生的许多过程的其他激酶。表格1)。
1.2. 安全
由于 CDKis PD 特性和细胞周期中的 CDK 活性,帕博西尼、瑞博西尼 和 玻玛西尼 对高增殖组织(例如骨髓和胃肠道黏膜)具有共同的毒性特征,包括血液和胃肠道疾病,例如贫血、中性粒细胞减少症、白细胞减少、恶心、呕吐和腹泻。然而,与第一代和第二代 CDK 抑制剂相比,帕博西尼、瑞博西尼 和 玻玛西尼 显示出更好的疗效和安全性,后者靶向所有或大部分 CDK 同工型。这种对 CDK 异构体的混杂常常导致无法区分生理和恶性增殖过程,从而导致严重的细胞毒性(骨髓抑制和贫血)。通过提高选择性,新的 CDKis 表现出不太常见和严重的血液学不良事件。相反,胃肠道疾病是 玻玛西尼 记录的最常见的不良事件,与 帕博西尼 和 瑞博西尼 相比,恶心和严重腹泻的发生率更高。由于这些原因,不应将 玻玛西尼 推荐给患有胃肠道合并症的患者。与显着参与造血的 CDK6 相比,不同的 玻玛西尼 耐受性概况可归因于 CDK9 的主要参与。因此,与 帕博西尼 和 瑞博西尼 相比,骨髓抑制和贫血发生率较低,中性粒细胞减少症很容易控制。此外,与第一代和第二代 CDK 抑制剂相比,更安全的 玻玛西尼 概况可归因于其对 CDK1、CDK7 和 CDK9 的总体效力较低。有趣的是,玻玛西尼 引起的腹泻可显着降低其吸收,因此通常建议预防性剂量的洛哌丁胺 8 mg [ 3 ]。
一个非常相关的安全问题涉及 瑞博西尼 和心律失常。事实上,在 III 期试验中,瑞博西尼 与 QT 间期延长有关,区别于 帕博西尼 和 玻玛西尼 [ 11 ]。最近的一项汇总安全性分析(1065 名接受 瑞博西尼 治疗的患者与 818 名接受安慰剂治疗的患者)显示,根据心率 (QT-c) 校正并通过 Fridericia 公式 (QTcF) 计算的 QT 间期 > 480 ms 发生率为 5% vs. 瑞博西尼 与安慰剂组中 1% 的患者,而 QTcF >500 ms 分别发生在 1% 与 <1% 的患者中。相反,对于 帕博西尼 和 玻玛西尼,没有报告与延长 QT 相关的相关不良事件。出于这个原因,在患有相关心脏病(心动过缓、长 QT 综合征、近期缺血性心肌综合征、心力衰竭和电解质异常)或假设伴随药物直接或间接诱导 QT 延长的患者中应避免使用 瑞博西尼。对于开始使用 瑞博西尼 的患者,需要进行心电图 (ECG) 监测以观察电生理后果。帕博西尼 和 玻玛西尼 与 瑞博西尼 不同,对 QT 间期没有直接影响,但不鼓励同时使用延长 QT 的药物。
每种化合物的注册试验中记录的主要安全问题的总结报告于表 2. 如 玻玛西尼 传单所述,注册后安全性数据警告使用 玻玛西尼 治疗的患者静脉血栓栓塞 (VTE) 和肺栓塞的风险增加。然而,越来越多的证据强调所有上述 CDKis 的 VTE 风险高于安慰剂组,这表明对接受 CDKis 治疗的患者要谨慎和额外监测。有关根据病理生理条件选择 CDKs 的可能理由,请参见第 7 节。
表 2
帕博西尼、瑞博西尼 和 玻玛西尼 注册试验中更多相关不良事件(根据 NCI-CTCAE 的 3 级或 4 级)的总结。CDKi、CDK4/6 抑制剂;ET,内分泌治疗;AI,芳香酶抑制剂。
| CDKi | 注册试用 | ET 骨干 | 报告 3 级或 4 级不良事件的患者 (%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 中性粒细胞减少症 | 白细胞减少症 | 贫血 | 感染 | 恶心 | 呕吐 | 腹泻 | 疲劳 | |||
| 帕博西尼 | 帕洛玛-2 | 人工智能 | 66.5 | 24.8 | 5.4 | 0 | 0.2 | 0.5 | 1.4 | 1.8 |
| 帕洛玛-3 | 氟维司群 | 76.1 | 33.8 | 2.8 | 3.2 | 0 | 0 | 0 | 0 | |
| 瑞博西尼 | MONALEESA-2 | 来曲唑 | 59.3 | 21 | 1.2 | 4.2 | 2.4 | 3.6 | 1 | 2.4 |
| MONALEESA-3 | 氟维司群 | 57.1 | 15.5 | 3.9 | 7.7 | 1.4 | 14.1 | 0.6 | 1.7 | |
| 玻玛西尼 |
MONARCH-1 (单一疗法) |
- | 28.9 | 27.7 | 0 | - | 4.5 | 1.5 | 19.7 | 12.9 |
| MONARCH-2 | 氟维司群 | 26.5 | 7.3 | 5.8 | 4.9 | 0.9 | 1.2 | 13.4 | 1.8 | |
| MONARCH-3 | 人工智能 | 23.8 | 8.6 | 7 | - | 1.2 | 1.5 | 9.5 | 1.8 | |
1.3. 药代动力学
口服药物通常比静脉药物具有更大的 PK 变异性。不管 CDKis 是具有相似 PK 特征的口服药物,帕博西尼 和 瑞博西尼 显示出与 玻玛西尼 不同的特征。根据在表3. 帕博西尼 和 玻玛西尼 被缓慢吸收,而 瑞博西尼 比 帕博西尼 和 玻玛西尼被更快地吸收。
表3
帕博西尼、瑞博西尼 和 玻玛西尼 药理特性的详细总结。
| 药理特征 | 帕博西尼 | 瑞博西尼 | 玻玛西尼 | |
|---|---|---|---|---|
| 剂量和时间表 | 125 毫克/每天 1-21 Q28 与食物 | 600 毫克/天 1-21 Q28 | 200 毫克,每日两次,单药治疗;每天两次,每次 150 毫克,与内分泌治疗相结合 | |
| 选择性 | CDK4 = CDK6 | CDK4 > CDK6 | CDK4 >> CDK6; 对 CDK1、CDK7 和 CDK9 的效力低 | |
|
亲脂性; 血脑屏障渗透 |
cLogP 值为 5,5;+ | 不适用 | cLogP 值为 2.7;+++ | |
| PK |
C max : 52 ng/mL T max : 7 h t 1/2 : 25.9 h Vd: 2793 L AUC 0–10 (ng/mlxh): 299 |
C max : 1000 ng/mL (亚洲人的更高值) T max : 5 h t 1/2 :32.6 h Vd: 1090 L AUC 0–24 (ng/mlxh): 20000 |
C max : 298 ng/mL T max : 8 h t 1/2 : 8 h Vd: 690.3 L AUC 0–24 (ng/mlxh): 5520 |
|
| 生物利用度 | 46% | 不适用 | 45% | |
| 结合蛋白 | 85% | 70% | 96–98% | |
| 代谢 | 肝脏:CYP3A 和 SULT2A1的底物 | 肝:CYP3A4的底物 | 肝:CYP3A4的底物 | |
| 排泄 | 在粪便中 | 74% | 69.1% | 81% |
| 在尿液中 | 17% | 22.6% | 3.4% | |
| 对 ADME 酶的影响 + 自身抑制 | CYP3A 的弱和时间依赖性抑制剂。帕博西尼 是 P-gp 和 BCRP 的底物并抑制 OCT1。 | CYP3A4 中/强剂量和时间依赖性抑制剂。瑞博西尼 是 P-gp 的底物。可逆的 CYP1A2、2E1 抑制剂。潜在地抑制 P-gp、BCRP、OATP1B1、OATP1B3、OCT1、OCT2、BSEP 和 MATE1。 | 玻玛西尼 是 P-gp 和 BCRP 的底物,可抑制 OCT2 和 MATE | |
| 活性代谢物 | 没有 | 不 | 是:N-去乙基玻玛西尼 (M2)、羟基玻玛西尼 (M20)、羟基-N-去乙基玻玛西尼 (M18) | |
| 食物摄入改变 | 禁食状态下的吸收和药物暴露较低 | 不 | 高脂肪和高热量膳食增加 AUC (9%) 和 C max (26%) | |
| 不良事件 | 中性粒细胞减少症 G3/4 | 恶心任何等级 | 任何等级的腹泻;疲劳任何等级。中性粒细胞减少症(罕见且可控制) | |
| 共同给药 CYP3A 抑制剂的作用 |
↑87% AUC ↑34% C max |
强抑制剂:↑3.2-fold AUC 和↑1.7-fold C max; 中度抑制剂:↑1.9-fold AUC 和↑1.3-fold C max (单次 400 mg 剂量后) |
强抑制剂:↑237% AUC(↑119% 的活性代谢物) 和 ↑30% C max(↑7% 的活性代谢物)中度抑制剂:↑1.7-fold AUC(↑1,3-fold 的活性代谢物) ) |
|
| 共同给药 CYP3A 诱导剂的作用 |
强诱导剂:↓85% AUC 和 ↓70% C max; 中度诱导剂:↓32% AUC 和 ↓11% C max |
强诱导剂:↓89% AUC ↓81% C max 中度诱导剂:↓60%AUC ↓37% C max (单次 600 mg 剂量后) |
强诱导剂:母体药物和活性代谢物的 ↓67% AUC 中度诱导剂:未知 |
|
| 儿科使用 | 没有数据 | 没有数据 | 没有数据 | |
| 老年人使用 | 安全性和有效性没有差异 | 安全性和有效性没有差异 | 安全性和有效性没有差异 | |
PK——药代动力学;CDKs——细胞周期蛋白依赖性激酶;AUC——曲线下面积;C max——血液中的最高浓度;T max——药物达到血药浓度峰值所需的时间;t 1/2 ——药物半衰期;Vd——分布体积;cLogP值——正辛醇与水对数之间的药物分配系数的对数;BBB,——血脑屏障;第 1 天至第 21 天 Q28——每天一次,连续 21 天,然后停药 7 天,组成一个完整的 28 天周期。
帕博西尼、瑞博西尼 和 玻玛西尼 是 P-糖蛋白(P-gp;ABCB1)和乳腺癌抗性蛋白(BCRP;ABCG2)的底物。它们都是外排转运蛋白,位于重要的解剖结构中,例如血脑屏障 (BBB)、近端小管细胞、肠细胞和肝细胞。这些转运蛋白通过 (a) 在小肠和结肠的面向内腔的上皮细胞以及肝脏的面向胆汁的小管中排出影响其在肠道中的生物利用度的口服给药药物的首过消除中发挥重要作用,(b)在肾脏近端肾小管刷状缘膜面向尿液的一侧从体循环排泄,以及(c)改变它们在不同靶组织中的治疗浓度,如在 BBB 中。特别是体外研究表明,帕博西尼 和 玻玛西尼 是 BBB 处 P-gp 和 BCRP 的底物,影响其通过,而 瑞博西尼 主要是肠道 P-gp 的底物,可能影响其口服吸收率而不是其吸收率。大脑浓度。_ 无论如何,来自体内实验的最新数据表明,瑞博西尼 与其他 CDKis 作为 BBB 的 P-gp 底物更相似。特别是,由于特殊的亲脂性,帕博西尼 和 玻玛西尼 很容易穿透 BBB,但与 帕博西尼 和 瑞博西尼 相比,只有 玻玛西尼 在较低剂量下达到并维持治疗浓度。这种在中枢神经系统 (CNS) 中的有利分布也可以通过 玻玛西尼 对 P-gp 和 BCRP 的剂量相关抑制作用来解释。相反,帕博西尼以及最近的体内证据,瑞博西尼似乎从脑脊液中大量去除。体外数据还表明,帕博西尼 和 瑞博西尼 可能会抑制肠道 P-gp 和 BCRP,并可能增加药物对血液的吸收。在体内没有这种相互作用的证据。
CDKis 给药后患者间和患者体内的变异性代表了这些化合物的相关问题,尤其是 瑞博西尼。瑞博西尼 不受食物摄入或胃 pH 值变化的影响,不同于 帕博西尼 和 玻玛西尼。据报道,帕博西尼 变异性在进食状态下会降低。在注册临床研究中,13% 在禁食条件下服用 帕博西尼 的所有患者显示出较低的 帕博西尼 暴露量。对健康志愿者进行的一项研究表明,C max较高在服用 帕博西尼 和高脂肪餐的受试者中。这可能是由于 帕博西尼 胶囊的溶解高度依赖于 pH 值,呈反比关系。玻玛西尼 的特点是癌症患者的广泛变异性,独立于人口统计学(性别、年龄、体重)。来自健康受试者的数据表明,增加 玻玛西尼 治疗的剂量和/或持续时间会导致吸收的剂量比例降低。食物摄入轻微改变 玻玛西尼 PK 曲线,但没有相关的临床后果;尽管高脂肪和高热量膳食使 AUC 增加 9%,C max增加 26%。玻玛西尼 的总体 PK 变异性不受食物效应的显着影响。
帕博西尼 和 瑞博西尼 与人血浆蛋白具有适度结合和高分布容积 (Vd),相反,玻玛西尼 与血浆蛋白高度结合,因此其特征在于较低的 Vd。
这三种药物都经过肝脏代谢,被 CYP3A4 代谢。瑞博西尼 的特点是 CDKis 中的半衰期最长,其毒性特征阻止了持续的时间表以及 帕博西尼的情况。玻玛西尼 可以改为连续给药。
帕博西尼 已显示成比例的剂量累积,影响 C max和 AUC 值,并且在单剂量给药时具有剂量依赖性 PK。由于它是 CYP3A4 的弱时间依赖性抑制剂,由于抑制其自身代谢,预计 帕博西尼 PK 在多剂量条件下呈剂量依赖性。相反,瑞博西尼 具有非线性 PK,并且在 600 mg 剂量给药时是强效 CYP3A4/5 时间依赖性抑制剂,在 400 mg 剂量给药时是中度 CYP3A4 抑制剂。瑞博西尼 也可逆地抑制 CYP1A2 和 CYP2E1。玻玛西尼 及其主要活性代谢物已被证明可下调 CYP 的 mRNA,包括 CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2D6 和 CYP3A4。
帕博西尼、瑞博西尼 和 玻玛西尼 尚未在妊娠期进行过研究,但多项体内研究表明存在致畸问题,因此不建议在该临床环境和哺乳期使用它们。
2. 潜在的药物相互作用
2.1 与 ADME 的潜在药物相互作用
下文将总结基于最常见合并症的潜在 DDI。根据共识研讨会的结果关于可以与 帕博西尼、瑞博西尼 和 玻玛西尼 安全同时给药的药物以及每个 FDA 传单,已经广泛描述了有意义的临床药物相互作用。使用传单中包含的信息并通过与其他 CDKis 的类比描述了具有 玻玛西尼 的 DDI。表 S1报告了 CYP3A4 的所有药物主要底物,敏感或治疗指数窄 (NTI) 的列表。
2.1.1。可能改变 CDK4/6 抑制剂吸收的药物
来自肠道的药物吸收可能是患者内部和患者间变异以及 PK 变异的来源。吸收表面积、通过肠道的时间、流向吸收部位的血流量以及胃和肠道 pH 值都是影响吸收的因素。
- (1)提高胃酸碱度的药物
影响吸收和因此药物生物利用度的最常见的相互作用是由于质子泵抑制剂 (PPI)、H2 受体拮抗剂或局部抗酸剂造成的胃 pH 值改变。酸还原剂对 CDKis 的影响仅在 帕博西尼 中进行了研究。在健康受试者中进行的两项临床试验发现,单剂量 帕博西尼 与多剂量 PPI 雷贝拉唑的共同给药降低了 帕博西尼 C max在进食和禁食条件下分别下降 41% 和 62%。相反,AUC 降低仅在禁食状态下相关(80% 对 13% 在进食状态下)。因此,考虑到局部抗酸剂和 H2 受体拮抗剂在降低胃酸度方面不如 PPI 有效,预计提高胃 pH 值的药物对进食状态的影响最小。尽管如此,帕博西尼 应避免同时使用 PPI。PPI、H2 受体拮抗剂或含有 瑞博西尼 和 玻玛西尼 的抗酸剂预计不会出现 DDI,这些药物可以在有或没有食物的情况下服用。
- (2)膜转运蛋白
2.1.2 可能改变 CDK4/6 抑制剂分布的药物
血浆蛋白结合可以对药物的 PK 和 PD 产生多重影响。只有游离药物才能产生治疗效果,因为它可以分布到作用部位并与受体相互作用。竞争性置换是蛋白质结合反应之间的主要相互作用,导致置换药物的游离血浆浓度增加。因为 帕博西尼 和 瑞博西尼 不是高度蛋白质结合(帕博西尼 85% 和 瑞博西尼 70%),所以预计不会与分布相关的 DDI。无论如何,发现 玻玛西尼 的平均结合分数为 96.3%,M2 为 93.4%,M18 为 96.8%,其活性代谢物 M20 为 97.8%。对于与血浆蛋白高度结合的药物,置换反应可能具有临床意义。未来的研究有必要评估和监测这些潜在 DDI 的影响。
2.1.3 可能改变 CDK4/6 抑制剂代谢的药物
所有 CDKis 的代谢都可能受到它们作为底物的 CYP 的强至中度抑制剂和诱导剂的不同程度的影响。帕博西尼、瑞博西尼 和 玻玛西尼 经历广泛的 CYP3A 介导的肝脏代谢。
- (1)CYP3A 抑制剂可能增加 CDK4/6 抑制剂血浆浓度
在 FDA 传单中,建议避免同时使用强 CYP3A 抑制剂(例如,克拉霉素、HIV 和 HCV 蛋白酶抑制剂、伊曲康唑、酮康唑、泊沙康唑、伏立康唑、利托那韦、沙奎那韦、葡萄柚),因为记录的 CDKis 增加可能导致毒性增加的血浆暴露。特别是,当与强效 CYP3A 抑制剂一起给药时,玻玛西尼 及其活性代谢物的血浆暴露量增加至具有临床意义的程度。当与 CDKis 共同给药时,强效 CYP3A4 抑制剂也可能导致 QT 间期延长的风险增加(见第 2.2 节).)。如果不能考虑对 CYP3A 抑制潜力较小的替代方案,则 CDKis 的剂量需要减少至 帕博西尼 的 75 mg/天 (↓40%)、瑞博西尼 的 400 mg/天 (↓33.33%) 和玻玛西尼 每天两次 100 mg (↓50/33.33%)。对于因不良反应已将剂量减至 100 mg 每天 2 次的患者,当与其他强效 CYP3A 抑制剂同时使用时,玻玛西尼 的剂量应进一步减至 50 mg 每天 2 次。如果停用强抑制剂,在抑制剂的五个半衰期后,CDKis 的剂量可以增加到抑制剂引入之前使用的剂量。关于中度抑制剂(如红霉素、环丙沙星、氟康唑、艾沙康唑、阿瑞匹坦、奈妥匹坦、硝苯地平、尼卡地平、维拉帕米、表3)。在 FDA 传单中,建议监测可能增加的毒性,而对于弱抑制剂(例如,替格瑞洛、西洛他唑、福沙匹坦、阿普唑仑),仅报告了暴露增加的低风险。剂量调整建议总结于表 4.
表 4
根据伴随药物和临床特征的剂量调整建议。第 1-21 天 Q28,每天一次,连续 21 天,然后停药 7 天,组成一个完整的 28 天周期。
>| 伴随的药物或病理生理状况 |
帕博西尼 125 mg 每天一次, 第 1-21 天 Q28 |
瑞博西尼 600 mg 每天一次, 第 1-21 天 Q28 |
玻玛西尼 150 毫克,每日两次,与内分泌治疗相结合; 200 毫克单药每日两次。连续时间表 |
|---|---|---|---|
| 强CYP3A抑制剂 | 避免。如果不可避免:75 mg/天起始剂量 (↓40%) * | 避免。如果不可避免:400 mg/天起始剂量 (↓33.33%) * | 避免。如果不可避免:100 mg,每日两次,起始剂量 (↓50/33.33%) * |
| 中度 CYP3A 抑制剂 | 监控 | 监控 | 监控 |
| 弱CYP3A抑制剂 | DDI 风险低 | DDI 风险低 | DDI 风险低 |
| 强CYP3A诱导剂 | 避免。考虑替代方案 | 避免。考虑替代方案 | 避免。考虑替代方案 |
| 中度CYP3A诱导剂 | 监控 | 监控 | 监控 |
| 弱CYP3A诱导剂 | DDI 风险低 | DDI 风险低 | DDI 风险低 |
| 肝功能损害建议 |
Child-Pugh A 或 B:无修改 Child-Pugh C:75 毫克/天起始剂量 |
Child-Pugh A:无修改 Child-Pugh B 或 C:400 mg/天起始剂量 |
Child-Pugh A 或 B:无修改 Child-Pugh C:150 毫克/天起始剂量 |
| 肾功能损害建议 |
轻度至中度:无修改 重度或血液透析:无数据 |
轻度至中度:无修改 重度:起始剂量降低至 400 毫克/天 (EMA) 或 200 毫克/天起始剂量 (FDA) |
轻度至中度:无修改 重度或血液透析:无数据 |
在与强和中度抑制剂共同给药后,每个 CDKi 的健康受试者 PK 参数变化的可用数据报告于表3,而表 S1中对最常用的 CYP3A 抑制剂进行了审查,并按潜在的药物相互作用风险进行了分类。
- (2)CYP3A 诱导剂可能会降低 CDK4/6 抑制剂血浆浓度
在与强和中度诱导剂共同给药后,在健康受试者中记录的每个 CDKi 的 PK 参数变化的可用数据报告在表3,而最常用的 CYP3A 诱导剂在表 S1中根据潜在的药物相互作用风险进行了审查和分类。
2.1.4 与 CDK4/6 抑制剂共同给药可能改变的药物
当 CYP3A4 主要底物与 CDKis 同时给药时,它们的血清浓度可能会由于 CDKis 对 CYP3A4 的抑制潜力而增加,并且可能需要减少剂量,尤其是与 瑞博西尼 一起使用(见第 1.3 节)。尤其是当共同给药的药物除了是 CYP3A4 主要底物外还具有 NTI 的特征和/或是敏感的底物药物时,尤其是当药物的微小变化可能引起毒性时(例如,阿芬太尼、环孢菌素、双氢麦角胺、麦角胺、依维莫司、芬太尼、匹莫齐特、奎尼丁、西罗莫司、他克莫司、辛伐他汀和阿托伐他汀;见表 S1)。FDA 将敏感底物定义为当 AUC 增加 2 倍或大于 2 倍至小于 5 倍时,强指数抑制剂可诱导 AUC 增加 5 倍或更多的底物,而中等敏感底物。与单独使用咪达唑仑相比,健康受试者与多剂量 帕博西尼 或 瑞博西尼 400 mg 和 600 mg 共同给药咪达唑仑血浆暴露分别增加 61%、3.8 倍和 5.2 倍。当高度蛋白结合的 玻玛西尼 与具有 NTI 的药物共同给药时,也可能需要谨慎。置换药物可以使置换药物的血浆浓度快速增加,这可能导致增强的药理作用和/或毒性。然而,没有关于如何处理这些类型的交互的指导方针。
根据 Bellet 等人,可考虑调整剂量的 CYP3A4、敏感或 NTI 的所有主要底物药物清单。,如表 S1所示。
用 CDKis 描述的其他 DDI 是由于对膜转运蛋白的竞争。CDKis 与二甲双胍联合给药时应谨慎,二甲双胍是肾脏 OCT2、MATE1 和 MATE2-K 转运蛋白的相关底物,因为存在降低肾脏清除率和二甲双胍分泌的风险。此外,在临床相关浓度下,已显示 帕博西尼 在体外可能抑制肠道 OCT1 以及肠道 P-gp 和 BCRP。此外,瑞博西尼 可能与 P-gp 和 BCRP 一起抑制 OATP1B1/B3、OCT1、OCT2、BSEP 和 MATE1,而 玻玛西尼 及其主要活性代谢物与 P-gp 和 BCRP 一起抑制 OCT2、MATE1 和 MATE2-K。虽然目前还没有可用的数据,但可以假设,在治疗剂量下,
2.1.5 止痛药(阿片类药物和非甾体抗炎药)
根据国际疼痛研究协会的数据,乳腺癌的疼痛患病率从 40% 到 89% 不等。疼痛控制确实是癌症患者面临的最大挑战之一。表 S1对最常用的疼痛控制药物进行了回顾和分类,并根据药物相互作用的潜在风险进行了分类。报告的高风险 DDI 涉及主要的 CYP3A4 底物/NTI 药物。2.2. 与可能增强 CDK4/6 抑制剂毒性的非 ADME 药物的潜在药物相互作用
下文将审查的有意义的 DDI 涉及 CDK 的作用机制,而不是它们的 ADME 配置文件。如我们的安全第 1.2 节所述,瑞博西尼 对电生理毒性有特殊警告,建议仔细监测和剂量中断、停药或剂量调整。已知有可能延长 QT 间期的药物,如抗心律失常药物(包括但不限于胺碘酮、丙吡胺、普鲁卡因胺、奎尼丁和索他洛尔)和其他已知可延长 QT 间期的药物(包括但不限于氯喹、 halofantrine、克拉霉素、氟哌啶醇、美沙酮、莫西沙星、bepridil、匹莫齐特和昂丹司琼)也可能增加 帕博西尼 和 玻玛西尼 用于 QT 间期延长的风险。
与 帕博西尼 和 玻玛西尼 不同,MONALEESA-2 试验表明,服用 瑞博西尼 的患者报告了更多的 QT 延长事件,与伴随治疗无关。在这方面,表 S1报告了 帕博西尼、玻玛西尼 和 瑞博西尼 之间由 DDI 引起的 QT 间期延长的风险差异。
抗抑郁药
抗抑郁药通常可用于治疗乳腺癌患者的焦虑和压力相关疾病,也适用于特定症状,例如失眠(米氮平和曲唑酮)、神经性疼痛(度洛西汀和阿米替林)、潮热(文拉法辛和 SSRIs)、食欲不振、恶心和/或呕吐(米氮平)和疲劳(安非他酮和哌醋甲酯)。一个主要问题是抗抑郁药对 QTc 间期延长和先进扭转型室速 (TdP) 风险的影响。西酞普兰和依他普仑延长 QTc 并存在已知的 TdP 风险,而米氮平和文拉法辛可能存在 TdP 风险。大多数抗抑郁药都存在带有 CDKis 的 DDI,要么通过 CYP3A4,要么主要通过 QTc 延长。
表 S1对最常用的抗抑郁药进行了审查,并按潜在的药物相互作用风险进行了分类。
2.3. 其他 DDI
2.3.1。骨质疏松症治疗(地诺单抗、维生素 D)
预计狄诺塞麦不会改变由 CYP3A4 代谢的药物的 PK。考虑到当全身(甚至局部)VitD3 水平波动时,维生素 D 补充剂可能会发挥作用,作为 CYP3A4 底物的药物的配置可能会发生变化。
2.3.2. 具有 CDK4/6 抑制剂的潜在 SULT2A1 介导的 DDI
尽管磺基转移酶 (SULTs) 酶参与了许多外源性物质的代谢,但很少有文献记载涉及这些酶的 DDI 的例子,同时考虑到不同亚型 SULTs 酶之间报道的重叠底物选择性。
一些药物已证明通过与核受体 (NR) 超家族成员相互作用来调节SULT基因表达(即,甲氨蝶呤通过与组成型雄烷受体 CAR 相互作用;染料木黄酮通过肝 X 受体 LXR;雌二醇通过雌激素受体 α,ERα;地塞米松通过激活孕烷 X 受体转录因子 (PXR) 和贝特类作为增殖物激活的受体 α 激动剂,PPARα 激动剂)。这可能导致首过效应增加,从而导致药物水平降低并可能丧失疗效。
SULT2A1 在体外被睾酮、克罗米芬、达那唑、螺内酯、环丙孕酮和氯丙嗪抑制。抑制 SULT 可能会降低药物代谢,导致药物浓度升高和可能的毒性。
非甾体抗炎药 (NSAID) 考来昔已显示通过引起雌二醇磺化的产物转换和增加整体雌激素磺化来调节 SULT2A1 的活性,对乳腺癌患者减少活性雌激素具有潜在的益处。具有 CDKis 的潜在 SULT2A1 介导的 DDI 具有不确定的临床相关性,也没有强有力的科学证据支持。
3.1。I期酶:CYP3A4和CYP3A5
与任何其他生物转化酶相比,人类 CYP3A 在更多药物的代谢中起主导作用。CYP3A 亚家族是肠上皮和肝脏中的主要同种型。编码 CYP3A 的基因聚集在 7 号染色体上的同一位点,连锁结果表明 CYP3A4 和 CYP3A5 之间具有高度的序列同源性和底物重叠特异性。CYP3A 表达在肝脏和小肠供体组织中变化多达 40 倍。越来越多的证据表明,CYP3A4和CYP3A5的遗传变异可能导致 CYP3A 酶表达和活性的巨大个体间差异,并最终影响对底物药物的反应。在人类肝脏中,CYP3A4 占大多数 CYP3A 同种型,而 CYP3A5 不均匀存在,可能仅在 20-30% 的人中表达。随着时间的推移,与其他高度多态的 CYP3A 酶(2D6、2C9 和 2C19)相反,很少有 SNP 会影响 CYP3A4 的表达或活性。
CYP3A4*22是位于内含子 6 ( rs35599367 ) 中的内含子 SNP,2011 年新颖报道它是导致 C > T 变体中 mRNA/蛋白质表达降低的原因。不管潜在的机制仍然未知,到目前为止,CYP3A4*22被认为是唯一与 CYP3A4 明显相关的变体,其活性降低了高达 50%。几项研究测试了CYP3A4*22对药物 PK 的影响。CYP3A4*22对肿瘤他莫昔芬和舒尼替尼而不是氯吡格雷和他克莫司代谢有显着影响。的相关性CYP3A4*22已被假设在没有活性 CYP3A5 酶的受试者(如大多数高加索人)中甚至更加增强。它的等位基因频率范围从高加索人的 5-8% 到亚洲和非洲人口的 4%,但尽管如此,它被证明具有临床相关性。不管CYP3A4*1B ( -392A>G , rs2740574 ) 是研究最多的 SNP,它的功能意义现在仍然被认为是有争议的,并且假设观察到的临床表型的真正原因归咎于CYP3A4*1B之间的连锁不平衡和另一个CYP3A等位基因(非洲人为CYP3A5*1,白种人为*3 )。其他变体已在非外显子调节区域中描述,其中大多数没有功能意义。
罕见的变异可能有助于解释临床观察到的对 PK 的影响,特别是在药物代谢中,它们可以提供一种有前途的新方法来解释观察到的总体药物反应的变化,而常见 SNP 无法证明这一点是合理的。在这种情况下,新一代测序 (NGS) 等新技术是非常有用的工具。有人提出,NGS 检测涉及药物 ADME 的基因的拷贝数变异 (CNV) 可能有助于进一步改善基因型-表型相关性。此外,外显子组测序可以通过以相对较低的成本评估个体中几乎所有基因的常见(即次要等位基因频率 (MAF) > 5% 和罕见 (MAF < 1%) 变异)来加速药物遗传学发现.
唯一被确定为导致功能丧失突变并导致 CYP3A4 蛋白形成有效丧失的变体是两个外显子罕见变体:*20 rs67666821 和*26 rs138105638 。CYP3A4*20和*26均引起过早终止密码子,产生缺乏催化活性的截短蛋白质。第一个*20是由一名巴西妇女以杂合子携带的(在白种人中计算的 MAF <0.006),而另一个*26是在一名患有 Alport 综合征的肾移植患者的纯合子中发现的。后者患者也携带非功能性CYP3A5 ( *3/*3基因型)导致迄今为止已知的第一例CYP3A酶活性有效失败的病例。
迄今为止,没有发布关于涉及CYP3A4的 DGI 的指南,也没有关于如何将CYP3A4基因型转化为表型的指南。然而,根据目前的证据,CYP3A4 代谢不良 (PM) 状态可以通过上述功能丧失的罕见变体的存在来定义。具有一个CYP3A4*22等位基因拷贝的个体将具有正常/中间代谢物(分别为 NMs/IMs)的预测表型,而具有两个变异拷贝的个体可被视为 IMs。因此,没有任何*22变体的个体将是 NM。
CYP3A5*3 ( rs776746 ) 是研究最广泛的CYP3A5 SNP,它赋予内含子 3 变体,导致异常剪接和无功能的 CYP3A5。它的等位基因频率从非洲裔美国人的大约 50% 到白种人的 90% 不等。CYP3A5 *6(主要是非洲人 15-25%)和*7 (亚洲人 1%)等其他不太常见的变化与 CYP3A5 活性降低有关,类似于*3观察到的变化。其他几种CYP3A5变体已被描述,但以相对较低的等位基因频率出现,其功能意义尚未确定。CYP3A5 *1等位基因产生功能蛋白(定义表达者表型和正常代谢者,NM),而常见的CYP3A5*3等位基因连同*6和*7将识别非表达者表型。具体来说,携带一个功能性等位基因和一个非功能性等位基因的个体是 IM,而携带两个非功能性等位基因的个体是 PM。CPIC 已经发布了关于他克莫司剂量调整的指南,这是基于与非表达者相比,具有表达表型的个体可能需要更高剂量的证据。
3.2. II 期酶:SULT
由胞质 SULTs 酶催化的硫酸盐结合是许多药物、神经递质和类固醇激素生物转化的重要途径。SULTs 酶表现出广泛的个体差异,尽管其对药物不良反应和疗效的临床影响尚未阐明。这种变异性仅部分由遗传变异解释,这表明其他非遗传、表观遗传和环境影响可能是 SULT 活性变异的主要决定因素。
SULT2A1 是该酶家族的成员,在人类肝脏、肾上腺皮质和小肠中高度表达。内源性化合物包括类固醇(雄甾酮、别孕醇酮、脱氢表雄酮)和胆汁酸。
SULT2A1中的种族特异性药物遗传学变异可能影响口服药物和/或内源性底物的生物转化。SNPs 和 CNVs 已被提议作为 SULT2A1 编码基因的遗传变异性来源。两个SULT2A1 SNP(rs2637125和rs182420)改变氨基酸序列和一个 CNV 导致非编码 2849bp 已被确定并与改变的 SULT2A1 活性有关。这些变异可能导致个体对药物的反应发生变异,但是目前关于 SULT 个体间变异性的知识是基于体外/体内药物遗传学和表达/活性研究。缺乏对人类的研究。
3.3. 对 CYP3A 活性有间接影响的基因的影响
CYP3A4/5基因型的变异对个体间差异的影响很小,而变异的主要原因可能来自 NR、细胞因子或 CYP3A 介导的药物代谢的竞争性抑制。NR1/2、PPARα和 P450 氧化还原酶 ( POR ) 等基因变异最近被确定对 CYP3A 活性有间接影响。PXR和维生素 D 受体 ( VDR)中的变异也可能在 CYP3A4 诱导中发挥作用。一些临床研究报告了更高的他克莫司剂量需求,表明 CYP3A 的代谢活性升高,与NR1/2 rs2276707和POR*28 rs1057868 相关。在后一种情况下,注意到的效果仅在患者 CYP3A5 表达者中。而 CYP3A4 mRNA 表达在患者的PPARα rs4253728纯合携带者衍生的细胞中显着降低。
NR 家族成员(法尼醇 X 受体,FXR;CAR;PXR 和 ERα)也是 SULT2A1 转录的重要调节因子。
3.4. 转运蛋白(ABCB1 和 ABCG2)
尽管有证据表明 ABCB1 表达和功能存在个体差异,但到目前为止,所有ABCB1描述的 SNP 都没有显示出与药物 PK 和 PD 的一致关联。ABCB1中研究最多的三个变体是两个同义 SNP,1236C > T , ( rs1128503 ) 在外显子 12 和3435C > T ( rs1045642 ) 在外显子 26;和一个非同义 SNP,2677G > T/A(外显子 21 中的rs2032582)。这些 SNP 处于高 LD定义ABCB1*13单倍型,并已在大多数种族群体中观察到。考虑到迄今为止获得的有争议的结果,没有建议对携带ABCB1序列变体的个体调整药物剂量,有必要进一步研究得出任何结论。然而,考虑到这些变体的存在与较低的 P-gp 表达相关,它可以确定无效的外排泵功能表型,从而影响口服 CDKis 的生物利用度。
根据 P-gp,由ABCG2基因编码的 BCRP 也是一种外排转运蛋白,负责限制许多常见药物的口服药物生物利用度和跨组织脑屏障的转运。它位于胃肠道、肝脏、肾脏、乳腺组织、胎盘、睾丸和脑内皮中。已证明ABCG2上的 SNP与治疗反应的个体差异密切相关。两个最常见的错义变体是c.34G>A ( rs2231137 ) 和c.421C>A ( rs2231142 )。根据多项研究,c.34G>A变体对转运蛋白的表达或功能没有明显影响,而c.421C>A显示降低 BCRP 的表达并导致较低的底物流出。与白种人和非洲裔美国人 (5-10%) 相比,东亚人 (30-60%) 的两个 SNP 的等位基因频率更高。ABCG2 c.421C>A基因型被发现是癌症患者中伊马替尼、吉非替尼和舒尼替尼。关于厄洛替尼,同样的关联,对毒性风险的影响,被发现仅在亚洲患者中显着。
DDI 诱导的表型转化的一个例子是强效 CYP2D6 抑制剂帕罗西汀,它通常与 CYP2D6 激活的他莫昔芬一起作为他莫昔芬诱导的潮热治疗以及抑郁症治疗。根据一些作者的说法,由于对 CYP2D6 相关的 DDI 缺乏关注, CYP2D6 PM 基因型与他莫昔芬失败的风险增加没有显着相关性。这种相互作用可以帮助识别更多数量的CYP2D6PMs 从 NM、IM 甚至超快速代谢物 (UMs) 状态转变为 phenoconverted。根据去年发表的一项基于人群的队列研究,在他莫昔芬期间使用帕罗西汀与乳腺癌死亡风险增加有关,这与共同处方的程度直接相关,这支持了帕罗西汀可以减少或消除其益处的假设。他莫昔芬用于乳腺癌女性。当他莫昔芬 75% 的时间与帕罗西汀重叠时,生存的调整风险比 (adjHR) 为 1.91,50% 时,adjHR 为 1.54,而 25% 时,adjHR 为 1.24。
5.1。肝功能损害
根据潜在的肝病及其严重程度,肝功能损害会影响药物的配置和代谢。严重的肝脏疾病,直至肝硬化,可通过不同的机制降低肝脏清除率、代谢和药物生物利用度,例如:(i) 血窦的毛细血管化,包括血窦内皮开窗的闭塞,这限制了药物从肝细胞的摄取;_ (ii) 肝酶活性总体不足;(iii) 血浆蛋白产量减少。
对于轻度至中度肝病患者,无需调整剂量,而对于 帕博西尼,严重肝功能不全患者(Child-Pugh C 级)必须以 75 mg 每天一次的剂量进行治疗.
对于 瑞博西尼,已在肝受损患者中进行了 PK 研究,显示对轻度受损患者的药物暴露没有影响,而在中度或重度受损患者中,暴露增加不到两倍。在另一项分析中也证实了这一结果,该分析比较了 160 名肝功能正常的乳腺癌患者和 47 名轻度肝功能损害的患者。
关于 玻玛西尼,一项针对不同程度肝损伤患者的 PK 研究表明,轻度或中度肝损伤患者的药物暴露量相似,尽管也描述了较低的Cmax 。在严重肝损伤中,肝功能正常患者的暴露量是肝功能正常患者的 2.09 倍(90% CI:1.33, 3.28)倍。同样,半衰期和 T max更长。相反,玻玛西尼 活性代谢物的 AUC 降低。在全球范围内,代谢物暴露量的减少超过了母体药物暴露量的增加。如 PK第 1.3 节所述, 玻玛西尼 与血浆蛋白高度结合。其血浆蛋白结合随着肝损伤严重程度的增加而降低。在肝功能正常的患者中,平均未结合分数为 3.7%,在中度和重度受损的患者中分别增加至 5% 和 7.8%。
尽管在临床试验中 CDKis 肝毒性的总体报道低于 10%,但在一些病例报告中,帕博西尼 与肝损伤有关。在报告的四例病例中,有三例被描述为致命的肝损伤。
瑞博西尼 的 III 期试验显示肝胆毒性发生率相对较高,主要是 3 级和 4 级毒性。
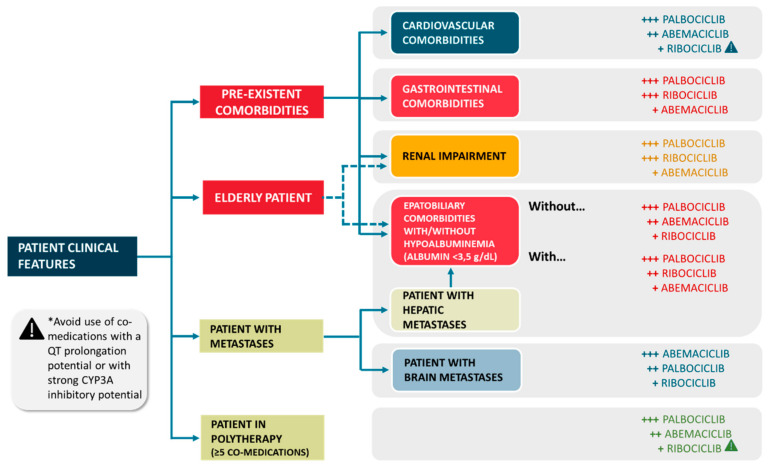
与肝功能损害相关的剂量调整详情见表 4和图 2.
5.2. 肾功能不全
在一项 PK 专门试验中,不同程度肾功能损害的患者(不包括血液透析患者)接受了 帕博西尼,并且在任何情况下都无需调整剂量 [ NCT02085538 ]。这些数据与一项人群 PK 分析一致,分别包括 73 名和 29 名轻度肾功能不全和中度肾功能不全的患者,这些患者未显示对 帕博西尼 的暴露量有所改变。
在接受 瑞博西尼 治疗的人群中,PK 分析比较了 77 名肾功能正常患者、76 名轻度肾受损患者和 35 名中度肾受损患者,未发现三组之间药物暴露的差异。最近一项 I 期研究旨在评估与肾功能正常的健康志愿者相比,肾功能不同程度受损患者的 瑞博西尼 PK 和安全性,证实轻度至中度肾功能不全患者无需调整剂量。对于严重肾功能不全的患者,建议每天一次 400 毫克的起始剂量 [ NCT02431481 。尽管如此,FDA 建议进一步减少 200 毫克的剂量,每天一次。
玻玛西尼 在肾功能不全患者中没有专门的 PK 研究。如第 1.3 节所述,它们的代谢主要是肝脏代谢,因此,根据临床前研究和群体 PK 分析,预计在轻度至中度肾功能不全的情况下不会改变排泄,并且不需要调整剂量。
与肾功能损害相关的剂量调整详情见表 4和图 2.
5.3. 性别和荷尔蒙状态
研究人员已经展示了性别差异如何影响药物治疗的安全性和有效性。这种差异的主要解释之一在于 PK 和药物遗传学差异。事实上,激素可以改变转运蛋白和酶的表达,并在胃排空中发挥作用。孕酮和雌激素可以调节胃的 pH 值和在胃和肠中的转运时间。事实上,女性的特点是胃液 pH 值较高,肠道运输量较低。如前所述,帕博西尼 的吸收高度依赖于胃的 pH 值,玻玛西尼 的吸收也受食物摄入的影响,这可能是由于 pH 值的改变。在此基础上,我们可以预期女性相对于男性的曝光率较低。相反,瑞博西尼 的吸收不受食物摄入的影响。此外,必须更多地考虑与胃 pH 值相关的生物利用度变化,因为肿瘤治疗与提高胃 pH 值的药物(例如质子泵抑制剂或 H2 阻断剂)经常相关。
可能影响药物暴露的男性和女性之间的差异也与转运蛋白和药物代谢酶有关。在肠道水平,男性和女性之间的 P-gp 表达没有差异,但在肝脏中,女性的 P-gp 表达是男性的两倍,CYP3A4 活性的一半 [ 106 ]。一些研究还表明,男性肝脏中 BRCP 的表达高于女性 [ 107]。这可以转化为男性对 帕博西尼 和 玻玛西尼 的更高清除率,从而可能抵消这些药物的代谢差异。此外,对于药物引起的 QT 延长,男性和女性之间存在显着差异。事实上,由于 QT 延长,女性发生 TdP 的风险更高 [ 108 ]。罗德里格斯等人。还证明了月经周期中的荷尔蒙变化与 QT 延长之间存在关联。Thus, we expect a higher risk of QT prolongation for women, especially those in premenopausal, that should be taken into consideration when the CDKi of choice is 瑞博西尼. 事实上,有人提出,内源性性类固醇激素随月经周期、怀孕和更年期的自然波动可能会影响整体药物疗效和安全性。绝经期循环雌激素的生理性减少与药物代谢酶的变化有关。根据 Paine 等人的说法。与绝经前女性相比,绝经后女性肠道中的 CYP3A4 活性降低了 20%。绝经状态对药物 PK 的影响研究很少。与绝经后状态相比,他莫昔芬治疗的乳腺癌患者表型为 CYP2D6 和 CYP3A 活性的 NM,绝经前状态与内多昔芬血浆浓度降低 135% 相关。作者假设绝经后患者肠道中较低的 P-gp 活性可能是他莫昔芬生物利用度增加的原因。可以推测,CYP3A4 和 P-gp 的底物药物,如 CDKis,可能会增加其在绝经后状态下的血浆浓度和毒性。
最后,值得提醒的是,CDK 4/6 抑制剂仅被批准用于女性乳腺癌。尽管这种病理学几乎有效是女性疾病,所有乳腺癌中不到 1% 发生在男性中,但仍需要对 CDKis 和男性乳腺癌进行进一步研究,以便在这种临床环境中为 CDKis 提供支持证据。此外,由于性激素在乳腺癌中的相关病理生理学参与,一些临床前和临床研究正在进行中,以测试 CDKis 在其他内分泌肿瘤如卵巢癌中的作用。
5.4. 炎症和癌症
由传染病或其他疾病(如癌症)引起的炎症与几种药物代谢酶表达的下调有关,并且如前所述,可以驱动表型转化现象。IL1、TNF、干扰素和 IL-6 等细胞因子主要参与这一机制。促炎细胞因子可以抑制药物代谢酶的生物合成,影响其数量,从而影响其药物代谢能力。这种影响已在体外和体内实验。在确认中,Rivory 等人。表明,在晚期癌症患者中,与没有急性期反应的患者相比,具有急性期反应(CRP > 10 mg/L)的患者的 CYP3A 代谢活性降低了 30%。这一观察结果并未考虑肿瘤疾病的类型,但 9% 的研究患者患有乳腺癌。这种表型转化可以改变药物代谢,使患者面临更高的癌症治疗不良事件风险。肿瘤组织还可以包含具有代谢药物能力的细胞色素 P450 酶。一项关于乳腺癌的研究揭示了 CYP3A4 和 CYP2C9 在癌组织中的过度表达。2016 年的另一项研究假设 PXR 介导的 CYP3A5 表达诱导(在一系列实体瘤中很常见)可以增加紫杉烷和酪氨酸激酶抑制剂的代谢。这些酶表达的影响仍未探索,但已被提议作为抗性机制发挥作用。一个更广为人知的耐药机制在于增加肿瘤对 ABC 外排转运蛋白的活性或合成,从而促进癌症药物的外排并降低细胞内药物浓度。在超过一半的 NCI-60 肿瘤细胞系中发现 P-gp 水平升高。
可能,NRs 活性可以在 flogosis 中被改变,因为它们被认为是重要的异种传感器,介导炎症对 ADME 基因表达的影响,并最终影响治疗结果。
关于 II 期药物代谢酶,磺化能力的降低与几种感染和炎症状况的急性期炎症反应有关。已经提出改变的药物代谢和胆汁淤积的发展与炎症中的 SULT2A1 抑制有关。随着肝脏疾病从脂肪变性到肝硬化的严重程度,磺基转移酶活性显着降低,可能导致药物水平和毒性增加。
5.5. 乳腺癌脑转移
10-16% 的乳腺癌患者发生脑转移。不幸的是,注册研究排除了脑转移患者,或者当他们包括他们时,如在 MONALEESA-3 病例中,没有讨论 CNS 的具体结果。在由脑转移引起的炎症情况下,药物通过 BBB 的渗透性可能会增加。BBB 负责确保 CNS 的稳态,这一功能由 CNS 内皮细胞解释,这些细胞富含紧密连接,主要属于 claudin(尤其是 Cldn5 和 Cldn3)和 occludin 家族。此外,周细胞、星形胶质细胞和小胶质细胞负责 BBB 的不渗透性。炎症与 BBB 破坏和渗漏有关,这与炎症介质(IL-1β、IL-6、IL-17、IFN-γ、TNF-α)。这些细胞因子还能够上调趋化因子和细胞粘附分子的表达,从而改变 BBB 的通透性。。
考虑到 P-gp 在转移性脑肿瘤患者的 BBB 中似乎没有如此广泛地表达并且所有 CDKis 都是 P-gp 介导的脑挤出的底物,可以进一步增加穿过 BBB 的渗透性。比较 帕博西尼 和 玻玛西尼 的 BBB 渗透性(比 瑞博西尼 更亲脂)的实验模型表明,玻玛西尼 的外排效率低于 帕博西尼。体外流出比分别为 4.1 和 12 。尽管如此,使用剂量远高于临床相关剂量。一项 I 期试验表明,可以在患者的脑脊液中测量 玻玛西尼 的浓度,并且可以在单次口服剂量 10 mg/kg 长达 12 小时后测量来自 14C 标记的 玻玛西尼 的放射性。Anders 等人已经证明,用 玻玛西尼 治疗的 58 名继发于 HR+ 转移性乳腺癌的脑转移患者的颅内临床获益。在 ASCO 2019。具体而言,6% 的患者确认有客观的颅内反应,38% 的患者确认颅内病变减少。持续 ≥ 6 个月的颅内临床获益率为 25%,而中位 PFS 为 4.4 个月(95% CI,2.6-5.5)。
在患有胶质瘤皮质同种异体移植瘤的小鼠与非荷瘤小鼠 中,以及在涉及反复性胶质母细胞瘤患者的 0 期试验的 PK 分析中,瑞博西尼 也显示出良好的 CNS 渗透,但在临床疗效方面 需要进一步研究。
在脑转移的特殊情况下,帕博西尼 也可能达到治疗浓度,无论是 BBB 的主要 P-gp 和 BCRP 底物。事实上,在神经肿瘤学会第 24 届年会和教育日上发表的一项对 帕博西尼 用于携带 CDK 通路改变的脑转移患者 的 II 期试验的中期分析结果显示,57% 的患者可评估帕博西尼 治疗后有颅内反应,中位总生存期为 6.5 个月(90% CI,3.8-13.6)。
5.6. 肥胖
肥胖患者的特征在于药物分布和消除的显着改变。这些患者的典型特征是由肝血流量和肝清除率增加引起的较高首过代谢。此外,肥胖患者的患病率较高,患有称为 NASH(非酒精性脂肪性肝炎)的疾病,其特征是脂肪浸润和肝脏炎症。肥胖受试者 90% 的肝活检显示具有这些特征。NASH 的发病率随着体重指数 (BMI) 的增加而增加,其患病率估计高达肥胖人群的 20%,在病态肥胖患者中高达 50%。如前所述,炎症可导致药物代谢酶表达减少。
此外,肾清除率受肥胖影响,事实上这些患者与肾小球高滤过状态相关,导致肾清除率增强。
由于多项研究表明,BMI 升高与乳腺癌发病率升高之间存在显着更强的关联。对于绝经后女性来说尤其如此,其中多项荟萃分析一直显示高肥胖、成人体重增加和 HR 阳性乳腺癌风险之间存在正相关关系。此外,一项研究表明,47.7% 的被诊断患有乳腺癌的患者肥胖。由于肥胖患者在该人群中的患病率非常高,因此需要进一步研究以确定肥胖患者的 PK 特征,正如 EMA-CHMP 发表的肥胖人群中 PK 和 PD 调查所建议的那样。
5.7. 年龄
药物 PK 的一些改变也是由年龄引起的。从药物吸收开始,老年人的胃酸分泌减少,使患者对 CDKis 的吸收更高。此外,由于暴露量较高,老年人的特征是首过代谢减少,可能是因为肝血流量和组织质量减少。体重组成和脂肪分布的显着变化,改变了药物在组织中的分布,这与衰老过程有关。帕博西尼 和 瑞博西尼 的特点是分布容积大,并且由于与年龄相关的修饰,老年人可导致更高的血清浓度。尽管没有证据表明血清蛋白的表达会随着年龄的增长而改变,但老年人营养不良的患病率很高,这可能会影响血清白蛋白浓度,从而导致 CDKis 的游离分数更高。在女性中,与男性相反,年龄也会导致 P-gp 表达减少,再次影响药物的生物利用度。考虑到乳腺癌风险随着年龄的增长而增加,并且超过三分之一的被诊断患有乳腺癌的患者年龄超过 70 岁,所有这些考虑因素都需要在治疗老年患者时特别谨慎。由于这是一个脆弱的患者群体,由于他们的肿瘤疾病和他们的年龄,不良事件的可能性增加,CDKis的使用和剂量应该是最合适的,以避免他们暴露于这些药物的过量浓度。
迄今为止,有几项研究旨在确定患者概况或生物标志物以预测对 CDKis 的耐药性,但尚未出现强有力的证据,对于这一相关未满足的医疗需求需要进一步研究。
迄今为止,种系宿主特征被认为是造成许多药物中观察到的个体间变异性的主要部分。对接受 CDKis 治疗的乳腺癌患者的亚群分析强调了它们在安全性和疗效方面的差异。CYP3A4/5和转运蛋白(ABCB1和ABCG2 )SNP 在亚群中的不同流行率已被提出在影响 CDKis PK 的 ADME 中发挥作用。同时,一些病理生理条件会导致 PK 参数的变化,无论是患者体内的食物摄入,还是患者间的肾或肝损伤、全身或局部炎症状态、一般临床状况、激素谱,以及最终的肿瘤分级/分期。
鉴于每种 CDKi 的药理学考虑,我们可以推测某些临床环境可能比其他环境更适合采用特定的 CDKi。考虑到所有可能导致 PK/PD 改变的因素(基于 DDI、DGI 和病理生理状况)的量身定制的治疗方法,确实可以代表一种创新的更安全的解决方案。它还可以代表 CDKis 使用临床决策的有效策略(图 2和图 3)。

例如,对于预先存在胃肠道合并症的患者,应避免使用 玻玛西尼,因为严重的恶心、呕吐和腹泻是最常见的不良事件,它们也能够改变 玻玛西尼 的 PK 曲线。相反,值得强调的是,由于较少发生中性粒细胞减少事件,玻玛西尼 与 CDKis 中最安全的毒理学特征相关。考虑到血栓栓塞事件的高风险,应先进 帕博西尼 合并心血管疾病的患者 与 玻玛西尼 和与 瑞博西尼 相关的 QT 延长风险。这在乳腺癌环境中具有临床意义,同时考虑到女性 QT 间期延长的风险更高,因为与男性相比,她们的 QT 间期通常更长。在有轻度肝功能不全的患者中,应避免使用 瑞博西尼,因为与其他 CDK4/6 抑制剂相比,它可能更频繁地诱发肝毒性。
帕博西尼 和 瑞博西尼 的特点是与血清蛋白的结合较低,因此考虑到肝功能障碍可导致低白蛋白血症并因此导致大量未结合(游离)药物,因此应先进用于晚期转移性疾病和肝脏定位的患者。在接受高度结合血清蛋白的 玻玛西尼 治疗的患者中,低白蛋白血症可能会引起毒性。根据这一特定人群的试验结果,在肾受损患者中,帕博西尼 似乎是最安全的选择,而其他 CDKis 的可用证据较少。同样,由于具有临床意义的 DDI 的发生率较低,帕博西尼 可能更适合用于合并症的复合疗法(定义为超过五种联合药物)的患者。图 3)。
可以假设 玻玛西尼 是脑转移患者的先进药物,因为它的亲脂性以及抑制 P-gp 外排泵的能力以及与其他 CDKis 相比以较低剂量在脑组织中达到治疗浓度的能力,此外其涉及 CDK1 和 CDK2 的多种作用机制,这与脑肿瘤发生有关。
总之,在选择一种或另一种治疗方法时应考虑许多药理学变量。CDKis 不仅受到与口服给药途径相关的众所周知的变异性的影响,而且还受到来自癌症患者相互作用的药物、药物遗传学特征和病理生理条件的研究较少的变异性的影响。特定 CDKi 的使用应从经验方法转变为更加个性化的方法,旨在减少变异性来源和为个体患者量身定制剂量,也通过治疗药物监测的帮助。剂量个体化是个体化医疗在癌症治疗等复杂环境中面临的主要挑战之一,尤其是在受这一大杀手影响的患者中。
所有这些考虑因素也可能具有其他相关含义,因为 CDK 一直在研究其他临床环境。事实上,它们在 HER2 过表达和三阴性乳腺癌中的疗效正在研究中,尽管 帕博西尼 作为单一疗法已经显示对三阴性乳腺癌没有疗效。此外,由于其复杂且尚未深入了解的作用机制,CDKis,尤其是 玻玛西尼,已在其他肿瘤(如胶质母细胞瘤、非小细胞肺癌、头颈部鳞状细胞癌、胰腺癌)的临床前模型中显示出令人鼓舞的结果。癌症、食管腺癌、黑色素瘤、结肠癌、骨髓瘤和卵巢癌。类似地,由于 CDKis 影响广泛的关键功能蛋白,一些研究已经研究了将 CDKis 与靶向免疫检查点的药物(例如 PD-1/PD-L1或与 PI3K-相互作用的其他分子)相结合的可能治疗策略。 AKT-mTOR 通路。
总而言之,CDKis 是有前途的治疗剂,需要对其所有临床药理学特性进行更深入的研究,以便适当地利用以代表最佳的安全性和有效性治疗选择。
- 【佳学基因检测】前列腺癌的基因突变检测的部分位点和内容(新增)...
- 【佳学基因检测】乳腺癌基因检测报告怎么看...
- 【佳学基因检测】乳腺癌28项基因检测价格...
- 【佳学基因检测】乳腺癌遗传因素大吗?...
- 【佳学基因检测】低遗传力性状有哪些...
- 【佳学基因检测】乳腺癌基因测定...
- 【佳学基因检测】乳腺癌基因检测正确率达到多少...
- 【佳学基因检测】乳腺癌基因检测结果分析...
- 【佳学基因检测】乳腺癌基因检测有哪些项目...
- 【佳学基因检测】乳腺癌基因检测项目名称...
- 【佳学基因检测】21基因多少不化疗...
- 【佳学基因检测】乳腺癌哪种病理最好...
- 【佳学基因检测】佳学基因解码基因检测...
- 【佳学基因检测】基因是什么...
- 【佳学基因检测】乳腺癌遗传测试方法...
- 【佳学基因检测】乳腺癌遗传测试怎么做...
- 【佳学基因检测】乳腺癌遗传检测...
- 【佳学基因检测】乳腺癌遗传性检测...
- 【佳学基因检测】乳腺癌遗传筛查...
- 【佳学基因检测】乳腺癌遗传基因怎么检测...
- 【佳学基因检测】乳腺癌遗传基因检测查哪些项目...
- 【佳学基因检测】乳腺癌遗传基因筛查...
- 【佳学基因检测】肿瘤基因检测价格表...
- 【佳学基因检测】基因检测的费用大概多少钱...
- 【佳学基因检测】HER2阳性是最轻的乳腺癌吗...
- 【佳学基因检测】不化疗和化疗哪个寿命长...
- 【佳学基因检测】乳腺癌基因检测报告怎么看...
- 【佳学基因检测】乳腺癌基因检测的费用大概多少钱...
- 【佳学基因检测】乳腺癌基因检测有必要吗...
- 【佳学基因检测】乳腺癌基因检测的作用与意义...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



