【佳学基因检测】白癜风遗传基因检查
什么是白癜风?
白癜风是一种慢性皮肤疾病,其特征是皮肤和粘膜上出现色素减退或无色斑块。这种病症是由于黑色素细胞的功能丧失或减少所致,可能影响到毛囊,并且可能伴随有全身性表现,如神经性耳聋、葡萄膜炎和甲状腺炎等。虽然白癜风本身不会带来严重的健康风险,但它会严重影响患者的生活质量,包括自尊心、社会交往以及职业发展。
白癜风的发病机制
白癜风的发病机制是复杂的,多因素作用的结果。遗传易感性、黑色素细胞自身的攻击以及免疫系统的失调都可能参与其中。遗传因素在白癜风的发病中扮演了重要角色,估计遗传风险占总风险的75%至83%。
白癜风的基因检测:科学基础
1. 白癜风的遗传因素
白癜风是一种具有多基因遗传模式的疾病。研究表明,白癜风的遗传风险涉及多个基因位点和遗传变异。基因检测可以帮助识别这些关键基因位点,从而预测个体的白癜风风险。
2. 基因检测的位点
通过连锁分析和全基因组关联研究(GWAS),研究人员已经确定了与白癜风相关的多个基因位点:
- NLRP1基因:位于17p13染色体区域,与自身免疫性疾病及白癜风相关。
- XBP1基因:位于22q12染色体区域,调节HLA II类基因的表达,并参与细胞对压力的反应。
- FOXD3基因:与欧洲人群的白癜风易感性相关。
- PTPN22基因:编码参与T细胞信号传导的酪氨酸磷酸酶,与多种免疫系统疾病相关。
- IKZF4基因:与T调节细胞的生成有关,并与白癜风风险相关。
- FOXP3基因:位于X染色体上,涉及白癜风的风险。
3. 组织相容性抗原(HLA)相关基因
HLA基因组区域与白癜风的发病机制密切相关:
- HLA-A*02、HLA-Aw*31、HLA-A*32、HLA-A*33、HLA-DQB1*06等基因型与白癜风的风险增加相关。
- HLA-A*09、HLA-Aw*19等基因型则与较低的风险相关。
基因检测的意义
1. 风险预测
基因检测能够帮助评估个体的白癜风风险。通过识别与白癜风相关的遗传变异,医生可以为个体提供个性化的预防建议和早期干预措施。例如,如果检测结果显示个体携带某些高风险基因变异,医生可以建议该个体采取预防措施,减少可能的环境触发因素,从而降低疾病的发生概率。
2. 早期诊断
基因检测可以帮助早期发现白癜风。对于那些有家族史或其他风险因素的个体,基因检测可以作为一种预警机制,帮助及早识别疾病,从而及早开始监测和治疗。
3. 个性化治疗
了解与白癜风相关的基因信息,可以帮助医生制定个性化的治疗方案。例如,如果某个基因与治疗反应的好坏有关,医生可以根据基因检测结果选择最合适的治疗方法,从而提高治疗效果。
4. 提高对疾病的理解
基因检测不仅有助于临床实践,还能帮助科研人员进一步了解白癜风的发病机制。这些知识可以促进新药物的开发和治疗方案的改进,为白癜风患者带来更多的希望。
白癜风遗传基因检查共识
白癜风是一种复杂的多因素疾病,遗传因素在其发病机制中扮演着重要角色。通过基因检测,我们可以识别出与白癜风相关的关键基因位点,从而预测疾病风险、早期诊断、制定个性化治疗方案,并提升对白癜风的整体理解。尽管目前尚无治愈白癜风的方法,但基因检测无疑为我们提供了更深入了解和管理这一疾病的工具。未来,随着技术的进步和研究的深入,基因检测在白癜风诊断和治疗中的应用将越来越广泛,为患者带来更多的希望和支持。
皮肤科疾病表征及基本知识介绍
白癜风是一种慢性、获得性色素异常,可促进自身免疫攻击黑素细胞,导致皮肤和粘膜上出现色素减退或无色斑块,可能影响毛囊,并可能伴有全身表现(例如神经性耳聋、葡萄膜炎、甲状腺炎)。其发病机制是多因素的;然而,将个体遗传易感性、黑素细胞自身攻击和免疫耐受机制失败通过基因解码整合在一起后,可以对诊断和治疗起到重要用用。
白癜风在世界各地的发病率差异很大,非洲(0.4%)、欧洲(0.4%)和大洋洲(1.2%)的发病率高于北美洲(0.2%)和亚洲(0.1%)。在中国,白癜风的发病率为 0.46%–0.68%,男女和种族之间没有差异。发病平均年龄为 20 至 30 岁,但儿童和老年人也可能患病。白癜风仍占皮肤科就诊的 1.4% 至 1.9%,占儿童皮肤科就诊的 3.5% 。
尽管白癜风不会表现出特定的皮肤症状,也不会带来严重的健康风险,但它会影响患者的生活质量,因为这种疾病带有强烈的耻辱感,会损害社会和职业关系、自尊和着装规范;女性、青少年和患有精神疾病的患者是受影响最严重的群体。
目前,白癜风尚无明确的治愈方法;然而,一些治疗方法已显示出良好的效果,在超过 80% 的病例中实现了一定程度的色素恢复。最近对其发病机制的理解取得了进展,促进了新的治疗方案的出现,这为患者带来了更充满希望的未来。
白癜风发生的致病基因鉴定:基因检测的科学基础
白癜风是一种复杂的疾病,其中遗传因素导致的风险估计为 75% 至 83%,而环境因素则占剩余的 20%。家族分组研究、双胞胎研究和分离分析等基因解码技术将该病定性为一种具有多基因遗传模式的多因素疾病。因此,每种遗传变异对易感性的个体贡献相对较低。
基因解码通过连锁分析绘制白癜风易感基因位点分布图
白癜风的致病基因鉴定基因解码分析遗传风险因素是通过是通过连锁分析和定位克隆进行的。连锁分析评估了白癜风家族中受影响个体染色体区域的非随机分离。七个基因座与白癜风易感性有关,其中四个在欧洲人群中观察到,三个在中国人群中观察到。17p13 染色体上的一个基因座是第一个与自身免疫性疾病相关的白癜风相关的基因组区域。17p13区域的定位克隆确定了NLRP1基因是白癜风连锁信号的可能来源。
22q12 染色体与白癜风的发病机制有关,调节XBP1基因表达的变异是 22q12 区域中显示的风险因素。XBP1是一种转录因子,可调节 HLA II 类基因的表达,参与细胞对压力的反应,并经常与自身免疫性疾病有关。在亚洲和南美洲个体中,已观察到 6p21 染色体上的 MHC 区域与白癜风之间存在联系。
HLA I 类和 II 类相关基因与白癜风的发病机制有关。通过归纳法对 HLA 进行精细定位,发现 HLA-DQB1 和 HLA-B 分别在残基 135 和 45-46 处的氨基酸变异是中国人群白癜风的重要危险因素。此外,增加 HLA-A*02:01 表达的启动子变异与常见白癜风有关。
1p31.3 – p32.2、7q21.11 和 8p12 三个基因座与欧洲人的白癜风易感性有关,4q13-q21 的一个基因座与亚洲人群的白癜风易感性有关。其中, FOXD3被认为是 1p31.3 – p32.2 的致病基因候选者,PDGFRA被认为是 4q13-q21的致病基因候选者,而其余两个基因座尚无候选基因。
除此之外,HLA-A*33、HLA-Aw*31、HLA-DR4、HLA-DR7 和 HLA-DQB1*0303 等已被确定为不同样本中白癜风的危险因素。另一方面,有研究表明 HLA-A* 09和 HLA-Aw*19 与该疾病的较低风险相关。
在中国,一项针对东南部地区患者的研究表明,HLA-A*02 和 HLA-DRB1*07 与白癜风易感性有关。HLA -A*02 也与中国、印度、斯洛伐克和德国北部人群的风险有关。同样,在中国、印度、斯洛伐克、意大利、摩洛哥、土耳其和阿曼的样本中也发现了 HLA-DRB1* 07。
此外,在巴西,HLA-DQB1*06 与白癜风(常见、肢端和混合型)易感性相关,而 HLA-A*32 与局部型(局灶性和节段性)相关。然而,这些发现与文献中的其他描述不同,表明 HLA-DQB1*06 和 HLA-A*32 与巴西人群特别相关。
全基因组关联研究和白癜风预测
GWAS(全基因组关联研究)使用病例对照和家族来测试位于人类基因组中的一组密集变异与感兴趣的表型的关联。迄今为止,已对欧洲和亚洲人群的白癜风进行了五次 GWAS。他们总共确定了50多个与白癜风风险相关的基因位点。GWAS 确定的大多数基因位点都是在欧洲人中检测到的,这表明存在特定的种族效应或研究设计或功效的差异。然而,七个非MHC基因位点与不同种族的受试者的白癜风有关。
在独立人群中观察到的风险效应加强了基因在白癜风病理生理学中的整体贡献。这七个多民族白癜风风险因素之一包括PTPN22基因,该基因编码一种参与 T 细胞信号传导的蛋白酪氨酸磷酸酶。有趣的是,PTPN22变异与多种与免疫系统相关的疾病有关,包括类风湿性关节炎、系统性红斑狼疮和克罗恩病,这使它成为自身免疫性疾病的多效基因。
IKZF4基因与欧洲和中国个体的白癜风有关,该基因对 T 调节细胞 (Treg) 产生 FOXP3 介导的基因沉默。位于X 染色体上的FOXP3基因也是多个种族白癜风的风险因素。
综合起来,这些关联凸显了 T 细胞在白癜风发病机制中的关键作用。其他几个种族的白癜风候选基因位点包括TNF 超家族成员FASLG和蛋白酶 GZMB,这两者都表明细胞凋亡失调在白癜风中起着作用。在欧洲人中发现的另一个与白癜风有显著非 HLA 关联的基因是 TYR 基因,该基因调节黑色素细胞中的黑色素生物合成。
GWAS 研究结果的转化方面超出了与疾病发病机制相关的机制的描述。白癜风风险等位基因的累积频率可用于计算个体成为病例的概率(使用多基因风险评分)。使用 GWAS 描述的白癜风常染色体风险变异,发现多基因风险评分的预测能力为 71%,这是复杂疾病中发现的最高值之一。
候选基因方法在概念上基于疾病发生的作用机理。自身免疫、黑素细胞粘附和代谢功能障碍被认为是白癜风病因之一,目前已对基于上述机制的几种基因进行了测试。值得注意的例子包括 DDR1 基因,该基因编码一种跨膜酪氨酸激酶受体,该受体是黑素细胞与基底膜的主要粘附蛋白,已证实与未受影响的皮肤相比,白癜风中的该受体下调。DDR1与E-钙粘蛋白(由CDH1编码)形成复合物,这对于维持上皮结构很重要。接近CDH1基因的变异与巴西个体的白癜风有关,将黑素细胞粘附缺陷与白癜风的发病机制联系起来。过度氧化应激导致的黑素细胞损伤是白癜风的另一个公认的候选机制。表皮中活性氧的积累会抑制 BCHE 酶活性。控制BCHE基因酶活性的变异与中国人口独立样本中的白癜风有关。
与白癜风相关的主要基因变化总结如下表1。
表格1:参与白癜风发病机制的主要基因和组织相容性抗原(HLA)
| 基因 | 表达 |
| NLRP1 | + |
| XBP1 | + |
| FOXD3 | + |
| PDGFRA | + |
| PTPN22 | + |
| IKZF4 | + |
| FOXP3 | + |
| DDR1 | - |
| HLA | 风险 |
| HLA-A*02 | ↑ |
| HLA-Aw*31 | ↑ |
| HLA-A*32 | ↑ |
| HLA-A*33 | ↑ |
| HLA-A*09 | ↓ |
| HLA-Aw*19 | ↓ |
| HLA-DQB1*06 | ↑ |
| HLA-DQB1*0303 | ↑ |
| HLA-DR4 | ↑ |
| HLA-DRB1*07 | ↑ |
| HLA-DR7 | ↑ |
形态功能变化
除了黑色素和黑色素细胞显著减少之外,白癜风患者的皮肤上皮和真皮上层都表现出形态学变化,这支持了基因解码关于白癜风发生的疾病机理的理解:除了黑色素细胞对氧化和免疫损伤的敏感性之外,其他因素也导致了疾病的发展。
组织病理学上,多达 78% 的白癜风表皮在基底层色素沉着较少,多达 48% 的病例可发现一些炎症浸润。在活动性白癜风病例中,组织病理学可能显示苔藓样界面性皮炎模式,表明自侵的焦点位于基底层。T淋巴细胞 (CD3+),尤其是细胞毒性表型 (CD8+),是浸润物中的主要细胞 (65.4%),在血管周围和附件周围分布的病灶周围皮肤中更为明显。因此,病灶周围皮肤被认为是白癜风炎症活动性最高的区域(图1,图 2)
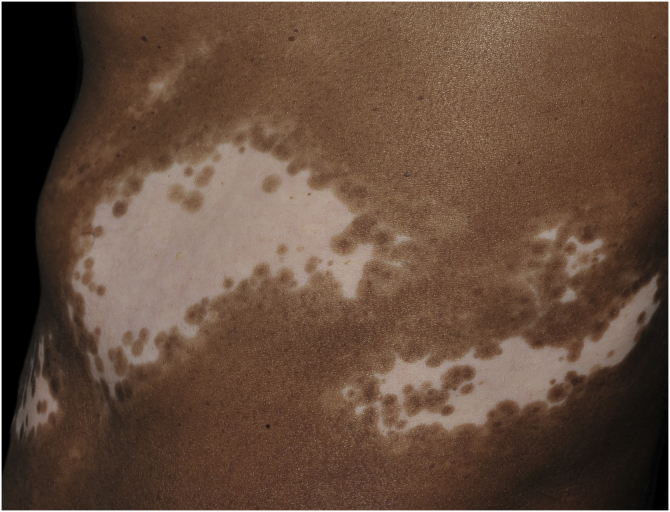
图1:深色皮肤患者侧腹的节段性白癜风。无色斑,呈带状分布;病变周围有白斑带,有数个毛囊复色点
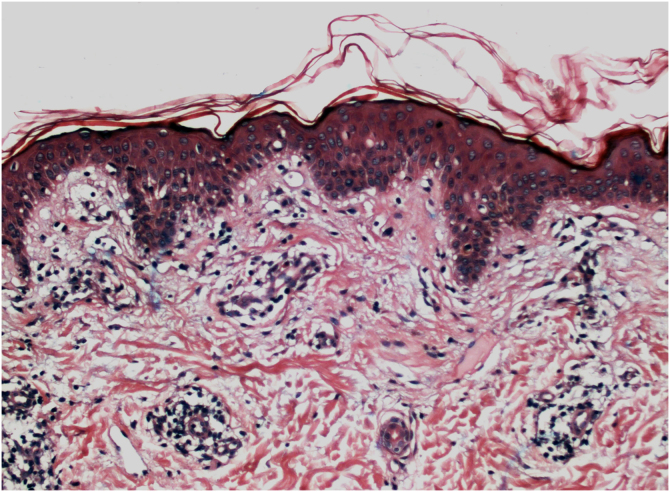
图 2:活动性白癜风。组织病理学:血管周围淋巴细胞浸润,表皮侵袭和基底层空泡变性灶(苏木精和伊红,×40)。
使用 Fontana-Masson 染色筛查黑色素沉着,在 16% 的白癜风病例中发现残留黑色素,在 12% 的病例中,在病变中发现了黑色素细胞,这表明患处可能不会完全破坏黑色素细胞。
电子显微镜下可见活动性白癜风存在黑色素生成异常,对照皮肤和稳定期白癜风病变周围区域的黑色素细胞呈现细长的树突,黑素体数量适中,而活动性白癜风病变周围区域的黑色素细胞树突则呈可回缩的树突,黑素体较少。表皮中朗格汉斯细胞增多,基底膜增厚,疾病活动期间可见基底黑素细胞和角质形成细胞发生退行性改变(如细胞质空泡化)。
基底层中残留的黑素细胞在白癜风的色素沉着过程中的作用仍不清楚,特别是因为病变中的黑素生成受到损害。然而,患处毛囊色素沉着的维持表明预后良好,因为可以通过光疗后毛囊周围色素沉着的识别来证明黑素细胞从外毛囊鞘迁移(图1)。
白癜风中色素沉积的主要来源是毛发外根鞘的黑色素母细胞,当不受 CD8+ T 细胞攻击时。在光疗刺激后,这些黑色素母细胞会迁移、分化为黑色素细胞并增殖到表皮中,这可能是通过上调干细胞相关基因GLI1实现的。
与非病变皮肤相比,白癜风病变的角质层和活力表皮厚度增加。病变上皮也有较大的角质细胞,可能是为了补偿角质化成分表达的减少,因此导致白癜风病变的角质层变厚。这一事实的一个可能解释可能是 D3 神经节苷脂表达减少,这有利于白癜风患者的角质形成细胞凋亡。这可能会诱导表皮增厚的补偿机制,以保护受影响的皮肤免受紫外线 (UVR) 的伤害。
然而,先前的光学和电子显微镜研究表明,白癜风患者受影响和未受影响的皮肤中的角质形成细胞都发生了退行性变化,这表明白癜风患者的整个上皮都容易受到该疾病的致病压力的影响。
在普通白癜风中,真皮-表皮交界处的上皮锥体减少。同样,在节段性和非节段性白癜风患者中也发现了结构差异。在节段性白癜风中,上皮锥体明显增加;与没有白癜风的对照组皮肤相比,非节段性白癜风患者中观察到棘皮症。
表皮细胞成分之间的粘附缺陷也与白癜风的发病机制有关。E-钙粘蛋白是一种有助于角质形成细胞之间锚定的蛋白质,在白癜风的黑色素细胞中已发现其表达量较低。在真皮层中也证实了这一点,非病变区域的 p53 阳性细胞中也存在这种反应,并且这种反应在白癜风病变中的反应性高于对照组。
白癜风中黑色素细胞的减少也与细胞粘附缺陷有关,但与细胞凋亡没有直接关系。此外,IFNγ 和 TNFα 等细胞因子会诱导黑色素细胞脱落,并减少 E-钙粘蛋白在黑色素细胞中的分布。然而,这两种细胞因子的组合能够下调编码E-钙粘蛋白的CDH1基因的表达,并降低与粘附缺陷相关的基因DDR1和CCN3的表达。此外,MMP-9 在普通白癜风患者的皮肤和血浆中升高,它是在 TNFα 和 IFNγ 的刺激下在角质形成细胞中产生的,与 E-钙粘蛋白裂解有关。
DKK1 蛋白可降低黑色素生成和黑色素细胞的某些躯体功能,这种蛋白在白癜风的病变成纤维细胞中过度表达。同样,与健康对照组相比,白癜风患者真皮中纤连蛋白(一种通过与整合素结合进行细胞间通讯的关键蛋白质)的表达也更高。此外,病变真皮中的弹性蛋白减少,但与未受影响的皮肤相比,胶原纤维没有差异。
(责任编辑:佳学基因)



