【佳学基因检测】白化病基因检测找到遗传或者不遗传的原因!
白化病基因检测在解析其遗传原因方面起着至关重要的作用。白化病作为一种经典的遗传性疾病,主要通过基因检测来确认是否存在与色素合成相关的基因突变,从而找到遗传或者不遗传的原因。以下是对这一问题的详细分析:
白化病的遗传机制
- 单基因遗传病:白化病是一种单基因遗传病,这意味着其发病是由单个基因的突变所引起的。具体来说,是由于与色素合成有关的基因突变后,导致黑色素不能正常合成,进而引发白化病。
- 常染色体隐性遗传:白化病主要呈常染色体隐性遗传模式。在这种遗传方式下,如果父母双方都是致病基因的携带者(即杂合子),他们本身可能不表现出白化病的症状,但他们的子女有1/4的几率成为纯合子(即携带两个相同的致病基因),从而表现出白化病的症状。
- X连锁隐性遗传:对于眼白化病这一特定类型,其遗传方式为X连锁隐性遗传。这意味着致病基因位于X染色体上,因此男性(XY)比女性(XX)更容易患病,因为女性需要两个X染色体都携带致病基因才会发病,而男性只需一个X染色体携带致病基因即可发病。
白化病基因检测的作用
- 确认遗传状态:通过基因检测,可以准确地确定个体是否携带白化病的致病基因,以及是杂合子还是纯合子。这对于预测个体的遗传风险、制定生育计划以及进行产前诊断具有重要意义。
- 指导临床治疗:了解白化病的遗传机制后,医生可以根据患者的基因检测结果来制定个性化的治疗方案。虽然目前白化病尚无根治方法,但基因检测有助于医生评估患者的病情严重程度、预测并发症的发生风险,并采取相应的预防措施。
- 遗传咨询:对于携带白化病致病基因的个体及其家庭成员,基因检测还可以提供遗传咨询服务。通过专业的遗传咨询,可以帮助他们了解白化病的遗传方式、发病风险以及预防措施,从而做出明智的生育决策。
不遗传的原因
虽然白化病是一种遗传性疾病,但并非所有携带致病基因的人都会发病。这主要归因于遗传的复杂性和多样性。在某些情况下,即使个体携带了致病基因,但由于其他基因或环境因素的作用,也可能不会表现出白化病的症状。此外,如果个体只携带了一个致病基因(即杂合子),他们通常也不会发病,而是成为致病基因的携带者。
白化病基因检测共识性意见
白化病基因检测是解析其遗传原因的重要手段。通过基因检测,可以确认个体是否携带白化病的致病基因以及遗传方式,从而为遗传咨询、临床治疗和生育计划提供科学依据。同时,也需要认识到遗传的复杂性和多样性,以及不同个体之间的差异性和不确定性。
白化病致病基因鉴定大数据分析
1208 名白化病患者接受了≤19 种白化病相关基因检测;这些个体之间没有血缘关系。在国际基因组协作联盟数据库中,又发现了 105 名白化病患者。该资源中还发现了一个由 29,497 名无血缘关系的个体组成的“对照”队列,这些个体没有记录的诊断或白化病特征(图1)。

图:1:病例对照致病基因鉴定基因解码思路
进行了病例对照分析,以深入了解蛋白质编码和调控变异(在等位基因频率谱的常见和罕见端)对白化病的贡献。病例队列中的大多数参与者(1208/1313)是通过基因解码数据库确定的。所有这些病患都至少具有白化病的一个关键眼部特征,即眼球震颤或明显的中心凹发育不全。其余 105/1313 病例是通过十万基因组计划数据集确定的,并被诊断为白化病或具有与部分/眼部白化病一致的表型。对照队列包括来自基因组学十万基因组计划数据集的 29,497 名无关个体,其中均无白化病诊断记录。研究了包括纯合状态的选定TYR单倍型的基因型。所指的单倍型是指由预测具有功能相关性的TYR变体组合形成的单倍型;三种变体符合针对调节( TYR c.-301C>T)和常见蛋白质编码(TYR c.575C>A 和 c.1205G>A)变体设定的预定标准。使用逻辑回归进一步分析了相关的单倍型区块。100K_GP Genomics England 100,000 基因组计划、eQTL 表达数量性状基因座、MAF 次要等位基因频率、CADD 组合注释依赖性耗竭评分、HGMD 人类基因突变数据库 v2021.2。TYR变体编号基于具有以下标识符的转录本:NM_000372.5和 ENST00000263321.6。
为了深入了解常见变异对白化病遗传结构的贡献,白化病致病基因鉴定研究了蛋白质编码变化的影响,这些变化具有次要等位基因频率 [MAF] ≥ 1% 并且通过计算算法预测具有功能相关(CADD 评分 ≥ 20)。对于TYR,已鉴定出两个这样的变异:c.575C>A(p.Ser192Tyr)[rs1042602] 和 c.1205G>A(p.Arg402Gln)[rs1126809]。已经记录了这两种变化的多种关联,包括与皮肤/头发色素沉着(两种变异)、黄斑厚度(c.575 C>A)和虹膜颜色(c.1205G>A)。此外,每一种变化都已证明会在体外降低酪氨酸酶活性。重要的是,有证据表明 c.1205G>A 是一种“次等位基因”变异,在复合杂合状态下,TYR改变完全丧失功能,会导致轻度白化病。还要注意的是,这种变异在欧洲人群中的 MAF 约为 27%,并且已报告多个未受影响的纯合个体(包括基因组聚合数据库 [gnomAD] v2.1.1 的控制子集中的 2000 多人)。
为了深入了解调控变异的作用,白化病致病基因鉴定研究了改变TYR调控元件(即TYR启动子或 ENCODE 列出的增强子)并影响TYR基因表达(即它们是已知的TYR表达数量性状位点 [ eQTL ])的变化的影响。已鉴定出一种这样的变异,即 c.−301C>T [rs4547091],这是一种胎儿视网膜色素上皮 (RPE) 选择性 eQTL。已知这种变化会改变TYR启动子中转录因子OTX2的结合位点,并且参考等位基因 (c.−301C) 已被证明会导致体外启动子活性显著下降。
只关注单个序列改变而不考虑变异相互作用和/或连锁不平衡模式,可能会掩盖复杂的潜在机制。为了克服这个陷阱,白化病致病基因鉴定避免对 TYR c. -301C>T、c.575C>A 和 c.1205G>A 变化进行独立分析,而是研究它们形成的单倍型块。可能会遇到 8 种可能的单倍型和 36 种可能的单倍型对 [2 3-1 × (2 3 + 1)]。白化病致病基因鉴定只关注包含纯合等位基因的 8 个单倍型对(图 2a) 有两个原因:(1)在纯合个体中,即使在没有分离/定相数据的情况下,也可以明确地确定潜在的单倍型;(2)在常染色体隐性遗传疾病(如TYR相关白化病)中,表型异常是两个等位基因综合作用的结果;通过仅分析纯合病例,可以更精确地分离和评估特定单倍型的影响。

图 2:常见的TYR变体形成影响白化病风险和视觉表现的单倍型
a显示了所研究的 TYR 单倍型。TYR c.−301C>T [rs4547091] 启动子变异的参考等位基因与较低的基因表达相关,显示为 C (↓);非参考等位基因与较高的基因表达相关,显示为 T (↑)。c.575C>A (p.Ser192Tyr) [rs1042602] 和 c.1205G>A (p.Arg402Gln) [rs1126809] 错义变异的参考等位基因以绿色字体突出显示,而非参考等位基因以红色字体突出显示。由于未检测到 TYR [ −301T;575A;1205A] 和 [−301T;575A;1205 G] 单倍型的纯合子,因此这些组合以灰色字体突出显示。b携带选定的纯合TYR单倍型的个体群体患白化病的风险 (即被诊断为白化病的概率) 。每个条形图的长度与每个优势比的点估计值成比例;还显示了相关的 95% 置信区间。使用以 1 为参考点的 log 10刻度;注意,优势比 >1 表示风险增加,而优势比 <1 表示风险降低。c携带选定的纯合TYR单倍型的英国生物银行参与者的视力测量分布。视力接近 0.0 LogMAR 被认为是正常,而视力 >0.5 LogMAR 被认为是中度/重度视力障碍。Kruskal-Wallis p值为 8 × 10 −11 。
白化病致病基因鉴定使用了 Firth 回归分析来研究TYR单倍型如何影响白化病风险(即被诊断为白化病的概率)。这种越来越受认可的逻辑回归方法旨在处理小型、不平衡的数据集(这在罕见疾病研究中很常见),并允许调整关键协变量(这在列联表方法中是不可能的)(图 1)。结果如图2 b所示。该分析确定了一些相关要点,如下所述。
白化病致病基因鉴定发现“次等位基因” TYR c.1205G>A 变体的外显率受TYR c.−301C>T 启动子变化的调节。当 c.1205G>A 处于纯合状态并与启动子变体的 c.−301C 等位基因(降低TYR表达)结合时,患白化病的风险很高(OR > 24;参见图2b 中的 [C;A;A] 和 [C;C;A])。相反,c.1205G>A 纯合子与 c.−301T 等位基因(增加TYR表达)相结合,具有保护作用(OR < 0.7;参见图 3 中的 [T;C;A]))。这一观察结果与先前的研究一致,表明外显率可以通过调节和蛋白质编码变体的联合功能效应来改变。白化病致病基因鉴定在此在隐性作用、部分功能丧失变体的背景下提供了这种机制的关键说明。
除此之外,白化病致病基因鉴定发现TYR c.−301C>T 启动子变体的纯合性可预防白化病 (OR 0.3–0.7;参见图2b中的 [T;C;A] 和 [T;C;G]))。值得注意的是,保护性 c.−301T 等位基因的等位基因频率在非洲血统人群中接近 80%,在欧洲血统人群中约为 40%。可以推测,TYR启动子位置的变异部分解释了非洲血统人群中TYR相关白化病患病率相对较低的原因。
白化病致病基因鉴定的研究结果还强调,启动子变体的 c.−301C 等位基因(降低TYR表达)与两个常见错义突变的非参考等位基因 c.575C>A 和 c.1205G>A 形成的单倍型的纯合性与白化病风险的显著增加相关(OR > 82;参见图中的 [C;A;A])。 2b)。尽管千人基因组计划 (第 3 阶段) 中约 1% 的欧洲血统人群存在这种单倍型,但它似乎与孟德尔突变相比,具有患白化病的风险。三项规模较小的研究结果支持这一结论,这些研究采用基于家庭的方法,研究了含有 TYR c.575C >A 和 c.1205G>A 变体的单倍型。
当TYR c.[−301C;575A;1205A] 和 c.[−301C;575C;1205A] 单倍型(对应图2b中的 [C;A;A] 和 [C;C;A]) 在病例队列的临床级分析中被考虑为孟德尔变异,诊断率从 57% (692/1208) 增加到 76% (916/1208)(图 3)需要注意的是,目前的遗传实验室流程通常不能很好地识别这些复杂的高风险单倍型,尤其是当过滤基于个体变异的罕见性时。
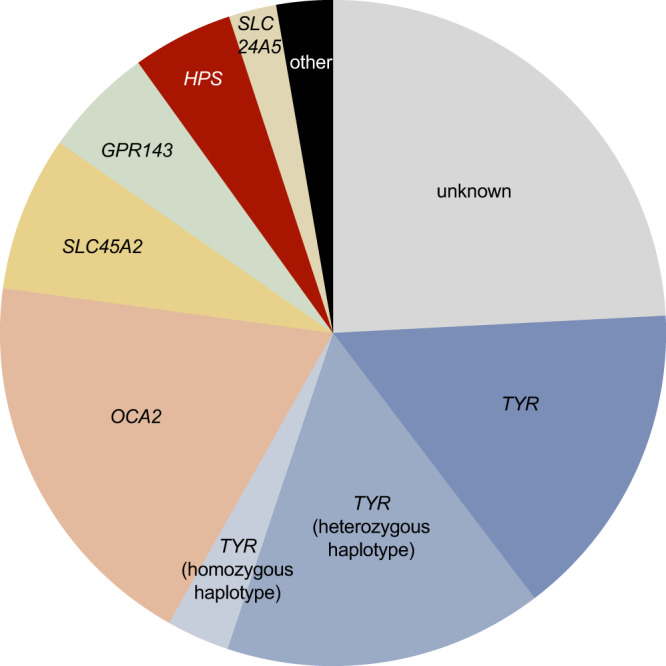
图 3:对白化病队列中的 1208 名病患进行高级分子诊断
24% 的病例无法进行分子诊断(“未知”类别)。其余先证者涉及以下基因:TYR(34%)、OCA2(19%)、SLC45A2(8%)、GPR143(5%)、Hermansky-Pudlak 综合征 (HPS) 相关基因(5%)、SLC24A5 (2%)、其他白化病相关基因(3%)。 TYR相关白化病病例中有相当一部分被发现/推测携带TYR c.[-301C;575A;1205A] 或TYR c.[-301C;575 C;1205A] 单倍型(15% 为杂合状态 [' TYR杂合单倍型' 类别];3% 为纯合状态 [' TYR纯合单倍型' 类别])。更多信息(包括所有分子诊断的列表)可以在补充数据 1中找到。
白化病致病基因鉴定随后研究了TYR c.[−301C;575A;1205A] 单倍型(对应图 中的 [C;A;A]) 的影响。2b) 在英国生物银行参与者中。白化病致病基因鉴定发现,具有这种单倍型纯合子的人平均视力降低(平均 LogMAR 视力 0.10;Kruskal-Wallis p值 8 × 10 −11,所有涉及 [C;A;A] 的成对比较均具有统计学意义;图2c)。由于视力是白化病的定量内表型,这一发现为这种复杂单倍型的功能重要性提供了额外的证据。在评估另一种白化病内表型——中央视网膜厚度时也观察到了类似的趋势(Kruskal-Wallis p值 <2 × 10 −16)。白化病致病基因鉴定期望未来对这组纯合个体的视觉功能和眼部结构进行分析的研究将为 RPE 黑色素合成与视觉系统组织之间难以捉摸的联系提供关键见解。此外,白化病致病基因鉴定预计针对这些纯合病例的特定细胞模型的研究(例如人类诱导多能干细胞衍生的 RPE)将加深白化病致病基因鉴定对白化病分子病理学的理解。
最后,白化病致病基因鉴定量化了罕见和常见变异组合相关的白化病风险。对于每个研究参与者,白化病致病基因鉴定估计了个人风险的两个关键因素。首先,白化病致病基因鉴定计算了白化病相关基因中罕见的、假定的孟德尔变异的数量;考虑了 MAF < 1% 且在人类基因突变数据库 (HGMD) v2021.2 40中标记为致病 (DM) 的单核苷酸变异。随后,白化病致病基因鉴定计算了TYR中常见“风险基因型”的数量(iec-301C、c.575A 和/或 c.1205A)。白化病致病基因鉴定发现,即使没有罕见的 HGMD 列出的变异 (OR > 3.6;表),存在 >4 种常见TYR风险基因型也会增加患白化病的风险 1)。白化病致病基因鉴定还发现,当单个杂合的 HGMD 列出的变异与 >1 种常见的TYR风险基因型同时出现时,患白化病的风险会增加(任何白化病相关基因的罕见变异的 OR > 4.2,TYR 的罕见变异的 OR > 1.2 ;表 1)这些观察结果为白化病家庭进行更精准的遗传咨询提供了基础。
表格1:不同类型的白化病相关变异对疾病风险的贡献。
| 常见a 型和罕见b 型风险基因型的组合 | 比值比c | 95% 置信区间 | p值 |
|---|---|---|---|
| 6 普通 + 0 稀有 | 391 | 165–982 | 0.000016 |
| 5 普通 + 0 稀有 | 7.8 | 3.6–16.5 | <0.00001 |
| 4 普通 + 0 稀有 | 3.4 | 1.9–6.1 | 0.000014 |
| 3 普通 + 0 稀有 | 1.5 | 0.8–2.6 | 0.17 |
| 2 普通 + 0 稀有 | 2.3 | 1.3–4 | 0.002 |
| 1 普通 + 0 稀有 | 1.1 | 0.6–1.9 | 0.84 |
| 0 普通 + 0 稀有 | 0.1 | 0.1–0.2 | <0.00001 |
| 6 普通 + 1 稀有 | 217 | 26.7–2519 | 0.00001 |
| 5 普通 + 1 罕见 | 302 | 156–566 | <0.00001 |
| 4 普通 + 1 稀有 | 38 | 22–69 | <0.00001 |
| 3 普通 + 1 稀有 | 8.7 | 4.9–15.6 | <0.00001 |
| 2 普通 + 1 稀有 | 7.5 | 4.2–13.5 | <0.00001 |
| 1 普通 + 1 稀有 | 6 | 3.2–11.2 | <0.00001 |
| 0 普通 + 1 稀有 | 2.6 | 1.2–5.3 | 0.016 |
| 0 普通 + 2 稀有 | 163 | 75–367 | <0.00001 |
| 6 普通 + 1 稀有TYR d | 120 | 6–17919 | 0.003 |
| 5 普通 + 1 稀有TYR | 178 | 82–425 | <0.00001 |
| 4 普通 + 1 稀有TYR | 38.6 | 20–80 | <0.00001 |
| 3 普通 + 1 稀有TYR | 5.3 | 2.6–11 | <0.00001 |
| 2 普通 + 1 稀有TYR | 2.4 | 1.2–5.4 | 0.02 |
| 1 普通 + 1 稀有TYR d | 0.6 | 0.2–1.9 | 0.43 |
| 0 普通 + 1 稀有TYR d | 2.3 | 0.4–8 | 0.28 |
| 0 普通 + 2 稀有TYR d | 446 | 100–4270 | <0.00001 |
a在一个等位基因中存在以下每种TYR变体均被视为一种常见风险基因型:c.−301C [rs4547091];c.575C>A (p.Ser192Tyr) [rs1042602];c.1205G>A (p.Arg402Gln) [rs1126809]。TYR变体编号基于具有以下标识符的转录本:NM_000372.5和 ENST00000263321.6。
b检查了常染色体白化病相关基因,并将人类基因突变数据库 (HGMD) v2021.2 中每个次要等位基因频率 <1% 且带有“致病”(DM) 标签的杂合蛋白质编码变化视为一种罕见风险基因型。TYR 基因中的此类基因型被标记为“罕见 TYR ”。
c以性别和血统为协变量的 Firth 回归分析用于估计优势比和未调整的p值;该分析包括 1313 名白化病患者和 29,497 名无关对照(补充数据 1)。
d这些类别的最小子群中包含不到 10 个人,从而降低了相关发现的可靠性。
本研究的一个潜在限制是白化病致病基因鉴定无法严格匹配白化病病例与未受影响的对照,特别是在近期血统方面(这可能与皮肤色素沉着相关)。虽然血统被纳入白化病致病基因鉴定的回归模型的一个参数,但这种分析并不完善,因为无法可靠地为大多数白化病病例分配遗传血统。众所周知,无法完全解释病例和对照之间祖先背景的差异可能导致假阳性关联信号。白化病致病基因鉴定采用了多种正交方法来评估白化病致病基因鉴定发现的稳健性和普遍性。首先,白化病致病基因鉴定使用 35 个假定的中性单核苷酸变异来计算基因组膨胀因子 lambda(λGC);发现λ中值为 1.04,与血统有限的混杂因素保持一致。随后,白化病致病基因鉴定对可用的队列进行了有针对性的子分析;三项重点病例对照研究的结果支持了白化病致病基因鉴定的主要发现,并增强了对所检测到的关联的有效性的信心。
总之,白化病致病基因鉴定已经表明,白化病风险的很大一部分源于与常见变异相关的遗传易感性。此外,白化病致病基因鉴定的研究结果表明,应在调节单倍型的背景下考虑TYR中罕见和常见的蛋白质编码变异。这里讨论的概念可能与理解其他罕见疾病有关,基于单倍型的方法有望缩小大量患者的诊断差距。未来的工作将涵盖更多不同的人群,并专注于将常见和罕见变异(包括单核苷酸和拷贝数变化)整合到单个遗传风险评分中。
(责任编辑:佳学基因)


