【佳学基因检测】原发性结肠副神经节瘤伴淋巴结转移基因检测辅助治疗
基因检测与结肠副神经节瘤的正确治疗
副神经节瘤是一种起源于肾上腺外的副神经节的神经内分泌肿瘤。胃肠道副神经节瘤非常罕见,佳学基因通过《肾上腺外副神经节与基因序列变化》收集了 4 例起源于结肠的副神经节瘤及基因检测辅助治疗案例。其中一例为起源于结肠的转移性副神经节瘤,该病例综合考虑临床信息、组织学、免疫组化、荧光原位杂交和二代测序分析基因检测结果建立了鉴别诊断。患者在治疗后的 14 个月内一直保持良好状态。由于所有副神经节瘤都有转移的可能性,副神经节瘤的鉴别诊断与正确治疗团队认为治好性手术切除和定期随访是必要的。基因检测可能提示转移风险和对治疗效果进行预测。由于结肠副神经节瘤非常罕见,因此鉴别诊断非常重要。通过建立《副神经节的临床与基因序列变化》,为罕见部位副神经节瘤的诊断和研究提供了经验。
副神经节瘤的鉴别诊断与基因检测辅助治疗
副神经节起源于神经嵴,包括交感神经节(如肾上腺髓质)和副交感神经节(如颈动脉体)。嗜铬细胞瘤和副神经节瘤 (PPGL) 均起源于副神经节,两者的区别在于肿瘤的解剖位置。嗜铬细胞瘤发生在肾上腺髓质,副神经节瘤发生在肾上腺以外的副神经节。PPGL 的发病率约为每 100,000 人 0.6 例 。PPGL的发病高峰在20~40岁人群中,遗传病例平均发病年龄为24.9岁,散发病例平均发病年龄为43.9岁,发病率之间无差异。性别条款 。在 2017 年 WHO 内分泌肿瘤分类中,PPGL 被归类为既往良性、交界性或生物学不确定性肿瘤的恶性肿瘤。WHO认为所有的PPGLs都有转移潜能,所以PPGL分为转移型和非转移型。该诊断被添加到美国癌症联合委员会第 8 版 TNM 分期系统 。PPGL多为散发,部分遗传,与多种基因突变有关。目前的研究报告了许多与 PPGL 预后不良相关的分子变化。因此,本病例除应用常规辅助诊断方法外,还完成了分子检查,为患者的后续诊疗提供思路和补充。
案例展示
一般信息
一名 49 岁男性患者因结肠占位性病变 8 个月到佳学基因合作医院检查。患者术前血压升高,高达150/110 mmHg;然而,他不记得发现血压升高的时间。服用患者记不起名字的降压药3个月后,血压未见下降。由于大便不规则,患者寻求医疗干预,结肠镜检查显示距肛门边缘 20-25 cm 的溃疡性肿块和直肠多发息肉。计算机断层扫描显示乙状结肠周围肠壁不规则增厚和强化,贼大直径约 5.9 cm。此外,肠系膜、腹膜后和左髂血管多处淋巴结转移,贼大约3.0 cm。肿瘤活检标本的病理学分析表明肿瘤可能是副神经节瘤。患者因阑尾炎和左腿外伤接受了手术。患者否认有任何辐射或化学暴露史。患者吸烟20多年,少量饮酒。所有家庭成员都身体健康。患者否认有任何辐射或化学暴露史。患者吸烟20多年,少量饮酒。所有家庭成员都身体健康。患者否认有任何辐射或化学暴露史。
治疗
患者术前接受替加氟联合替莫唑胺新辅助化疗,共四个周期(具体剂量:替加氟60mg口服,每日2次;替莫唑胺300mg口服,每日1次)。新辅助化疗后肿瘤和转移淋巴结的贼大直径减小。患者接受了乙状结肠切除术、网膜切除术、腹壁结节切除术和骶骨腹膜后淋巴结清扫术。
病理诊断
肿瘤主体位于肠壁肌层和浆膜下层,侵犯局部浆膜和黏膜固有层。形态学上,肿瘤类似于巢状和器官状结构。肿瘤细胞胞浆丰富,核异型性明显,核分裂象<1/10高倍视野。观察到轻度淋巴血管侵犯和神经侵犯。部分肿瘤细胞轻度变性伴间质性玻璃样变,与治疗后轻度反应一致。此外,还可以看到淋巴结(18/33)和肿瘤结节中的转移性肿瘤(图1 ))。由于在患者的影像学检查和手术过程中没有发现其他肿瘤,因此首先考虑了结肠的原发性肿瘤。免疫组化染色结果(图2):AE1/AE3、CK18、EMA等上皮标志物均为阴性,提示可排除低分化腺癌和神经内分泌肿瘤的诊断。CD56、Chromagranin-A、突触素、SSTR2和NSE等神经内分泌标志物呈弥漫性强阳性表达,支持副神经节瘤的诊断。S-100、SOX10 和 GFAP 的免疫染色突出显示了支持细胞,可以在 Zellballen 的外围发现不同数量的支持细胞或散布在肿瘤细胞之间。HMB-45阴性,MelanA呈弥漫性中度表达,不能排除透明细胞肉瘤的诊断,需要分子检测进一步诊断。此外,Desmin、SMA、CD117、TTF-1均为阴性。Vimentin呈弥漫性强细胞质阳性。GATA3呈弥漫性核阳性,抑制素呈局灶性阳性,CD34呈血管阳性。Ki-67 标签指数约为 5%。SDHB呈弥漫性阴性,代表突变表达。
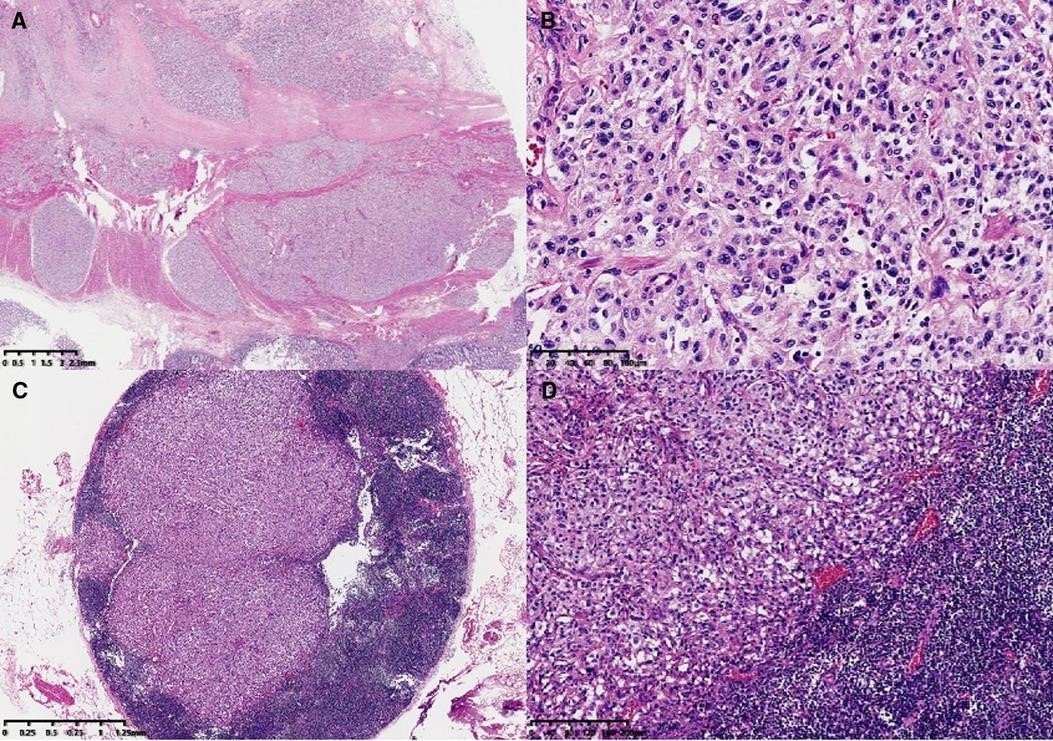
图 1。微观特征。肿瘤主体位于结肠壁肌层和浆膜下层(A,×6)。高倍镜下,肿瘤形态呈巢状、器官样结构(Zellballen型)(B,×200)。淋巴结转移(C,×20;D,×100)。
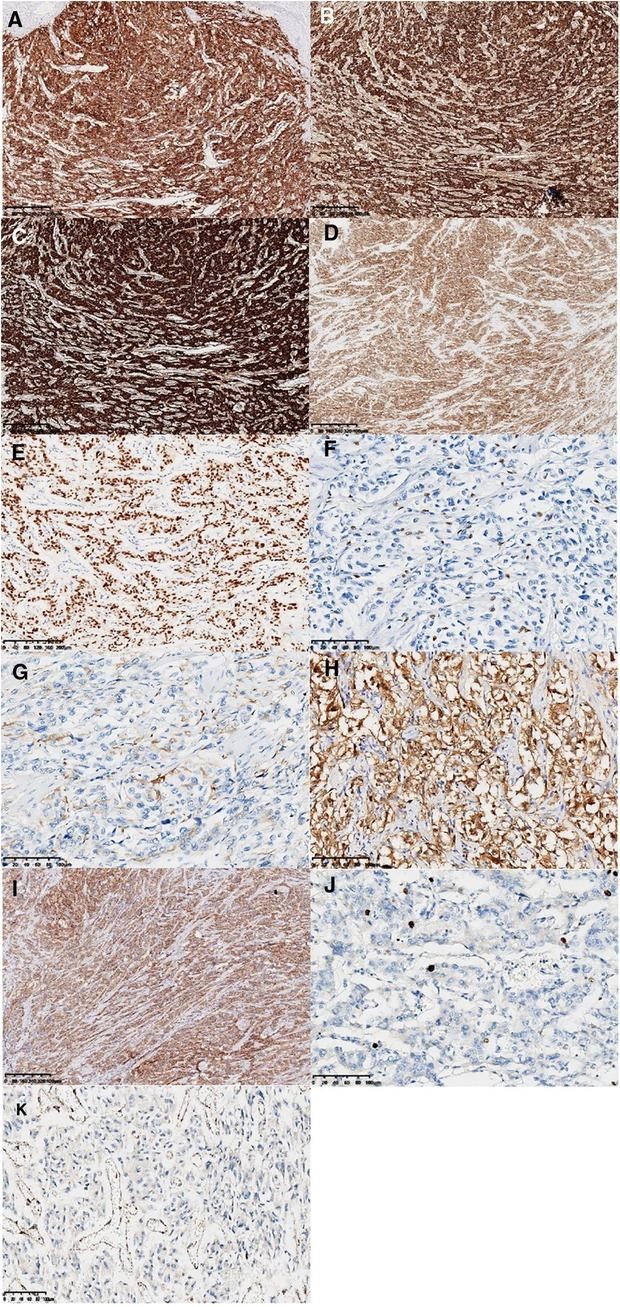
图 2:免疫组化染色结果。神经内分泌标志物:CD56、ChrA、Syno 和 NSE 呈弥漫性强阳性表达(A,×40;B,×40;C,×40;D,×40)。GATA3呈弥漫性核阳性(E,×100)。支持细胞通过 SOX10、GFAP 和 S-100 免疫染色(F,×200;G,×200;H,×200)突出显示。MelanA 表现出弥漫性中度表达(I,×40)。Ki-67 标记指数约为 5% ( J , ×200)。SDHB呈阴性表达(K,×200)。
鉴别诊断:胃肠道透明细胞肉瘤、上皮胃肠道间质瘤、低分化腺癌、结肠神经内分泌瘤和复合性神经节细胞瘤/神经瘤和神经内分泌瘤。
贼终病理诊断:结肠副神经节瘤伴淋巴结转移(18/33)。根据GAPP评分,肿瘤被诊断为中分化型。
基因突变测试
EWSR1(22q12)染色体易位阴性,荧光原位杂交试验显示。结果不支持透明细胞肉瘤的诊断。
提取来自配对肿瘤和正常福尔马林固定石蜡包埋样品的 DNA 用于下一代测序 (NGS)。NGS检测到外显子1的SDHB基因体细胞突变(c.2 T > G,p.M1?)(图3)。还检测到ATRX基因 (p.R2028*)的外显子 26 中的突变。
 和正常 ( B ) FFPE 样本的比较.jpg)
图 3:肿瘤 ( A ) 和正常 ( B ) FFPE 样本的比较。NGS检测到外显子1的SDHB基因体细胞突变(c.2 T > G, p.M1?)
随防和结果
患者术后恢复良好,积极随访。术后患者血压正常,稳定。截至目前,术后17个月未见反复或转移。
副神经节瘤的基因检测对辅助诊断和治疗中的作用
副神经节瘤的位置与人体内副神经节的正常分布区域基本相同。副神经节瘤常见于颈动脉体、腹主动脉、肾门和下腔动脉。回顾国内外文献表明,发生于胃肠道的副神经节瘤非常少见,多见于胃部,文献报道起源于直肠的文献较少。结肠副神经节瘤极为罕见,文献中仅报道了 4 例。Yao 等报道了首例结肠副神经节瘤。1997 年。报告的四例结肠副神经节瘤病例均无转移。此外,由于时间较早、技术不成熟或专业侧重不同,部分已报道的结肠副神经节瘤病例的临床和病理资料有限。我们报告了我们的转移性副神经节瘤病例,其表现为原发性结肠肿瘤,目的是拓宽临床和形态学谱,并提供更完整和详细的临床和病理数据,这将为未来对罕见部位副神经节瘤的任何研究提供经验支持。
包括本例在内的5例结肠副神经节瘤分析显示,患者男女比例为2:3,年龄分别为12岁、40岁、49岁、58岁、78岁(6~9岁)。肿瘤的平均贼大直径为 3.16 cm。本例肿瘤主体位于肠壁的肌层和浆膜下层,其余大部分病例肿瘤主要位于黏膜下层。这5例肿瘤细胞均呈巢状排列,呈Zellballen型,间质血管丰富。免疫组化结果与我们的病例相似。所有病例的神经内分泌标志物均呈阳性,S-100 突出显示支持细胞。此外,目前有3例副神经节瘤起源于直肠的报道,我们的结论是显微镜形态特征和免疫组化结果与我们的病例相似,主要是器官样巢. 然而,这3例直肠源性病例的细胞增殖活性较高,Ki-67指数分别为20%、41%和50 %,在上述8例中,仅三人进行了 SDHB 免疫组织化学染色,并被诊断为与 SDHx 相关的副神经节瘤。只有我们报告的病例进行了下一代测序。
大多数 PPGL 是散发性的,但研究表明,大约 40% 是遗传性肿瘤,并且与≥20 个已知易感基因的种系和/或体细胞突变有关 。在这些易感基因中,贼重要和贼常见的有琥珀酸脱氢酶x(SDHx)、受体酪氨酸激酶(RET)、VHL(von Hippel-Lindau)和1型神经纤维瘤病(neurofibromatosis type 1,NF1),它们来自功能类别广泛,与肿瘤发生的机制有关。研究发现,PPGL患者发生远处转移、局部反复或区域淋巴结转移的时间与多种分子标志物显着相关,包括MAML3融合基因、SDHB种系突变、SETD2或ATRX基因体细胞突变、超体细胞突变,Wnt通路改变,和高甲基化亚型。上述分子变化会导致无病生存时间减少;相反,血浆和/或尿液变肾上腺素或肾上腺素阳性、激酶信号表达和低甲基化与较长的无病生存时间相关 。目前的研究还发现,TERT的变化, RDBP和FH基因与 PPGL 预后不良有关。在这种情况下,肿瘤相关基因的NGS测序显示SDHB基因和ATRX基因存在不同程度的变异。而且本例淋巴结转移灶较多,达到18/33,也印证了上述SDHB基因与ATRX基因突变相关性及预后不良的研究结果。
转移性 PPGL 的定义是在排除反复或局部肿瘤浸润时存在转移性病灶。转移性 PPGL 的发生率<1 / 1,000,000。副神经节瘤的转移比嗜铬细胞瘤更常见,并且在初步诊断时观察到的转移甚至更罕见,发生在大约 10% 的嗜铬细胞瘤和大约 34% 的副神经节瘤中 。PPGL 患者贼常见的转移部位是淋巴结、骨、肝和肺。在这种情况下,超过一半的淋巴结中存在转移癌。目前,该患者未观察到术后反复或转移,继续服用替加氟和替莫唑胺。转移性 PPGL 患者的 5 年生存率为 12% 至 84% 。对 1,338 名转移性 PPGL 患者的荟萃分析显示,5 年和 10 年死亡率分别为 24%–51%(七项研究,n = 738)和 17%–42%(两项研究,n = 55)。一项针对 169 名转移性 PPGL 患者的多中心回顾性研究表明,中位生存时间为 6.7 年,发生部位(颈部和颅底),年龄 <40 岁,儿茶酚胺水平增加不到 5 倍,低增殖指数(每 10 个高倍视野中有丝分裂≤3 和/或 Ki-67 ≤ 2%)与更好的预后相关。
目前对转移性 PPGL 的治疗选择包括手术切除、靶向放射性标记载体(如 131I-MIBG 或 90Y-DOTATE 或 177LUTATE)、热消融、化疗和放疗 。然而,到目前为止,还没有标准的化疗方案用于治疗转移性 PPGL。环磷酰胺、长春新碱和达卡巴嗪 (CVD) 化疗方案目前用于治疗转移性 PPGL。一项回顾性研究显示,约三分之一的患者在接受 CVD 治疗后出现有效或部分缓解,表现为肿瘤缩小和儿茶酚胺分泌减少。这种效应会随着时间的推移而保持,但并非所有转移性 PPGL 患者都适合 CVD,并且一些患者会出现疾病进展 。
结肠副神经节瘤需要与下述肿瘤相鉴别。
(1)胃肠道透明细胞肉瘤:这种肿瘤来源于胚胎期神经嵴产生的原始黑色素细胞。肿瘤细胞大小相对均一,多为圆形,偶见梭形,多呈巢状或束状排列,由纤维间隔物隔开。在这种情况下,S-100 和 MelanA 的表达对鉴别诊断产生不利影响。在副神经节瘤中,S-100 仅存在于细胞巢周围的支持细胞中。在透明细胞肉瘤中,S-100 表达更强,可能伴有 HMB-45 和 MelanA 阳性。分子检测也有助于胃肠道透明细胞肉瘤的鉴别诊断;其特征性的EWSR1-ATF1/t(12;22)(q13;q12)染色体易位可作为分子病理学诊断的依据。
(2)结肠腺癌:结肠副神经节瘤的免疫表型具有一定的特点。肿瘤细胞表达神经内分泌标志物,如 Syno、ChrA、CD56 和 NSE,但不表达上皮标志物 CK 和 EMA。上述特征可与结肠腺癌相鉴别。
(3)结肠神经内分泌肿瘤(NETs):虽然NETs和副神经节瘤都表达神经内分泌标志物,但NETs表达上皮标志物,而副神经节瘤不表达。此外,据报道 GATA3 在 NETs 中呈阴性,在副神经节瘤中呈阳性,这也有助于区分 。
(4)上皮性胃肠道间质瘤:胃肠道间质瘤来源于肠壁Caja细胞,特异性表达分子标志物DOG-1和CD117,可用于鉴别诊断。
复合性神经节细胞瘤/神经瘤和神经内分泌瘤(CoGNET):副神经节瘤缺乏神经节细胞,表达GATA3。CoGNET 通常发生在十二指肠,并且几乎总是表达细胞角蛋白。但是 CoGNET 对 GATA3 是负面的。此外,副神经节瘤的分子改变如 SDHx 突变也有助于鉴别诊断。
结肠副神经节瘤是一种非常罕见的原发性结肠肿瘤。其预后可能与多种分子变化有关。明确的诊断应基于组织病理学形态、免疫表型和分子诊断,以识别结肠中可能发生的其他肿瘤。并且应该尽快进行手术。
Front. Surg., 09 August 2022
Sec. Surgical Oncology
https://doi.org/10.3389/fsurg.2022.961514
A case report of primary colonic paraganglioma with lymph node metastasis
(责任编辑:佳学基因)


