【佳学基因检测】胰腺导管腺癌 (PDAC)的诊断和治疗需要基因检测吗?
胰腺癌的致癌过程
胰腺癌具有多种组织学分类,各类型在胰腺癌的发生、发展、生物学特性、临床表现和治疗反应上存在差异,其中以胰腺导管腺癌 (PDAC) 最为常见,占比超过 90%(>90%)。因此,本篇将简要介绍 PDAC 的致癌过程,作为代表性示例。
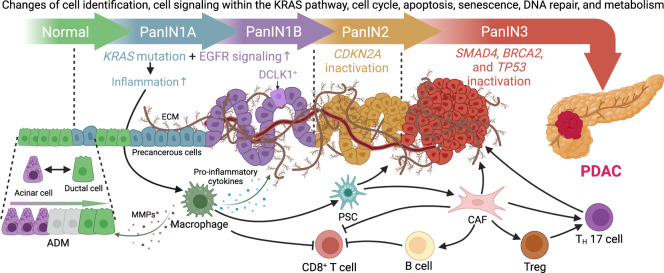
通常,胰腺癌从初期发展到临床上可被检测到的阶段需要超过 20 年的时间。这为肥胖和糖尿病等因素在胰腺癌发生过程中提供了充足的时间窗口。PDAC 的细胞来源至今仍存在争议,腺泡细胞和导管细胞在转化潜能上都有差异。然而,研究表明,原癌基因 KRAS 的突变是导致胰腺癌发生的最常见事件,也是癌症启动的关键调节因子。在癌前病变(如胰腺上皮内瘤变,PanIN)的发展过程中,肿瘤抑制基因往往会被逐步抑制或失活,涉及的基因包括细胞周期蛋白依赖性激酶抑制剂 2A (CDKN2A)、肿瘤抑制因子 p53 (TP53) 和 SMAD 家族成员 4 (SMAD4) 等。换言之,仅有 KRAS 基因的单一突变不足以引发细胞转化,其他基因突变的积累才会导致细胞识别、KRAS 信号传导、细胞周期、细胞凋亡、衰老、DNA 修复和代谢等方面的功能紊乱。PanIN 分为 1~3 级,只有 PanIN3(高级别发育不良)才是原位癌的真正前兆。在这些肿瘤中,细胞异质性表现为化生上皮和低级别发育不良,其中有许多簇状细胞参与了周围腺体组织的炎症反应。神经内分泌类型的 PanIN 能够响应神经元信号,进而促进病变的生长,并且这些细胞常常会脱落并侵入周围基质,促进转移,甚至在尚未形成癌症的情况下就有转移倾向。
PDAC 的促纤维增生基质中包含胰腺星状细胞(PSC)、激活的癌相关成纤维细胞(CAF)、肿瘤相关巨噬细胞(TAM)、其他免疫细胞、癌细胞和微血管。这一免疫抑制的微环境特征在于炎症反应的紊乱和细胞外基质(ECM)异常,能够有效阻止癌细胞被免疫系统识别和攻击。作为肿瘤微环境(TME)的重要组成部分,TAM 在胰腺癌的致癌炎症环境中起着至关重要的作用。首先,致癌性 KRAS 通过激活核因子 κB(NF-κB)、信号转导和转录激活因子 3(STAT3)、糖原合酶激酶 3(GSK3)/活化 T 细胞核因子(NFAT)通路,推动癌前病变中的促炎信号传导,其中炎性巨噬细胞通过分泌刺激介质,促进腺泡细胞去分化、腺泡到导管上皮化生(ADM)以及癌前病变的形成。接下来,炎性巨噬细胞通过上调金属蛋白酶或基质金属蛋白酶(MMP)组织抑制因子,促进 ADM,从而重塑腺泡微环境。然而,仅由 KRAS 突变引起的局部炎症并不足以导致胰腺癌的发生,这还需要其他的炎症反应和基因改变作为“燃料”。在 PanIN1 病变中,分泌的炎症细胞因子会激活巨噬细胞的表型转化,这对抑制炎症并促进病变的生长起着至关重要的作用。最后,TAM 通过抑制 T 细胞的免疫作用,并调节纤维蛋白的形成、血管化及血管生成,促进 PDAC 的上皮-间质转化(EMT)、侵袭性和转移。
肿瘤微环境中的其他成分也参与了 PDAC 的起始过程。来自多种来源的 CAF 负责合成包含多种成分的细胞外基质(ECM),而 PSC 则是促纤维增生反应的主要贡献者。在正常胰腺中,静止的胰腺星状细胞(PSC)在急性或慢性炎症过程中被激活,并且其形态转变为肌成纤维细胞样细胞,从而增强细胞外基质(ECM)的合成。因此,大量的癌相关成纤维细胞(CAF)和富含胶原蛋白及透明质酸的 ECM 有助于血管系统的形成,并增加组织张力,进而创造一个缺氧的微环境,这改变了肿瘤的代谢特征,这一过程对癌变至关重要。此外,与 PDAC 中 T 细胞功能抑制导致癌细胞增殖、免疫逃逸和转移相反,B 细胞则通过增强细胞增殖、抑制抗肿瘤免疫并以多种方式促进癌症的进展和转移(如图 1 所示)。
总的来说,KRAS 基因的突变是胰腺癌发生过程中的最早事件之一,它通过诱导炎症反应,并促进腺泡细胞、导管细胞、免疫细胞及成纤维细胞之间的相互作用,激活内在的致癌途径,这些途径共同形成了一个有利于肿瘤进展各个阶段的免疫抑制和纤维化微环境,从而增强了肿瘤细胞的可塑性。无论病理特征如何变化,肥胖、糖尿病以及胰腺癌中普遍存在炎症反应、免疫异常和纤维化的微环境异常。因此,可以推测,这些相似性可能是胰腺癌发生的主要驱动因素。为进一步了解这一过程,本文将更详细地回顾 PDAC 的致癌过程。
哪些基因参与胰腺癌的发生过程——基因解码揭示根本原因
有利于PDAC形成的PanIN的进展和微环境
(ADM腺泡至导管化生、CAF癌症相关成纤维细胞、CDKN2A细胞周期蛋白依赖性激酶抑制剂2A、DCLK1双皮质素样激酶1、ECM细胞外基质、EGFR表皮生长因子受体、KRAS Kirsten大鼠肉瘤病毒致癌基因同源物、MMPs基质金属蛋白酶、PanIN胰腺上皮内肿瘤、PDAC胰腺导管腺癌、PSC胰腺星状细胞、SMAD4 SMAD家族成员4、TP53肿瘤抑制因子p53、Tregs T辅助细胞、TH辅助T。)
在胰腺导管腺癌(PDAC)的形成过程中,胰腺上皮内肿瘤(PanIN)的进展和微环境发挥着重要作用。正常情况下,导管细胞能够转分化为腺泡细胞,这是胰腺为了维持其正常功能所进行的补偿性再生过程。同时,在炎性巨噬细胞通过分泌基质金属蛋白酶(MMP)刺激的作用下,高度可塑性的腺泡细胞能够通过化生过程(即腺泡到导管的转变)转化为导管细胞。在致癌KRAS突变的存在下,这些细胞保持其导管表型,并随之增强表皮生长因子受体(EGFR)信号传导,同时伴随肿瘤抑制基因(如CDKN2A、TP53、BRCA2和SMAD4)的失活,最终形成原位癌。
最初,致癌KRAS通过激活巨噬细胞中的促炎信号传导,并通过产生MMP来促进腺泡细胞的导管化生(ADM)。此外,KRAS突变还促进炎性细胞因子的分泌,推动肿瘤微环境的变化。在低级别的PanIN病变(如PanIN1A、PanIN1B和PanIN2)中,一些来源于腺泡的丝氨酸/苏氨酸蛋白激酶DCLK1+细胞被认为充当具有癌症干细胞功能的祖细胞。
在此过程中,巨噬细胞激活胰腺星状细胞(PSC),使其转变为癌症相关成纤维细胞(CAF),进一步增强促纤维化反应并促进ECM的生成,进而增加组织张力并在PanIN病变内形成缺氧的微环境。这种微环境中充满了癌前化生上皮和丛状细胞。CAF还可以激活免疫抑制性的B细胞、调节性T细胞(Treg)和TH17细胞,并与巨噬细胞协同作用,破坏CD8+ T细胞的抗肿瘤免疫功能。
在这一过程中,癌前细胞通过增强的KRAS信号传导逐渐发生转化。这种免疫抑制微环境中的细胞周期、凋亡、衰老、DNA修复和代谢异常,共同促进了PDAC的形成。
胰腺导管腺癌 (PDAC)的诊断和治疗需要基因检测吗?
胰腺导管腺癌 (PDAC) 的诊断和治疗中,基因检测可以提供重要的信息,虽然不是所有患者都需要常规进行基因检测,但在一些情况下,它对于个性化治疗和预后评估至关重要。
基因检测在诊断中的作用
对于胰腺导管腺癌的诊断,常规的影像学检查(如CT、MRI、内窥镜超声等)和组织活检是基础方法。然而,基因检测可以帮助确认病变的分子特征,尤其是在以下情况下:
- 高风险人群筛查:例如家族性胰腺癌或遗传性综合征(如BRCA突变、Lynch综合征等)的人群,基因检测可以帮助识别潜在的遗传突变,提前诊断或监测。
- 肿瘤分子特征分析:通过基因检测可以发现KRAS突变、TP53、CDKN2A、SMAD4等基因的突变,这些基因变化是PDAC发展的重要驱动因素。这些突变有助于癌症的分期、预测以及个体化治疗策略的制定。
基因检测在治疗中的作用
基因检测在PDAC治疗中具有以下几个重要用途:
- 靶向治疗:基因检测可揭示患者肿瘤中可能存在的靶点,如BRCA突变(可应用PARP抑制剂治疗)、HER2扩增、KRAS突变等。特定的靶向药物或免疫治疗可能对具有特定基因突变的PDAC患者有效。
- 预后评估:某些基因突变与PDAC的预后相关。例如,SMAD4和TP53的突变通常与不良预后相关。通过基因检测可以帮助医生评估患者的病情,并做出相应的治疗决策。
- 个性化治疗方案:基因检测能够揭示肿瘤的特定分子特征,从而为患者量身定制个性化的治疗方案,优化治疗效果并减少副作用。
3. 基因检测的挑战与局限性
尽管基因检测有助于提供精准的诊断和治疗方案,但在PDAC的常规治疗中,基因检测仍然面临一些挑战:
- 样本获取困难:胰腺肿瘤的组织样本采集较为困难,尤其是在局部晚期或转移性肿瘤患者中,但这一困难可通过行多次活检或使用液体活检(通过血液或其他体液检测DNA片段)进行解决。
- 基因突变的多样性:PDAC是一种高度异质性的肿瘤,多个基因突变可能存在于同一患者的不同部位,导致治疗策略的制定更加复杂。
- 药物可用性限制:虽然基因检测能够发现潜在的靶点,但针对某些基因突变的靶向药物可能仍处于临床试验阶段,尚未广泛应用于常规治疗中。
总结
基因检测在胰腺导管腺癌的诊断和治疗中可以提供重要的分子信息,尤其在靶向治疗和预后评估方面具有潜在价值。然而,基因检测并非每位患者都必须进行,它的应用更多是根据病人的具体情况和治疗需求来决定的。随着基因检测技术的进步和靶向药物的研发,未来在PDAC的个性化治疗中,基因检测的作用将更加突出。
(责任编辑:佳学基因)