【佳学基因检测】儿童缺乏维生素D做基因检测正确吗?
什么是维生素D缺乏症?
根据《人体疾病及健康异常的基因解码及遗传性分析》,维生素D缺乏引起的健康问题被分为维生素D缺乏症和生化性骨软化症。维生素D缺乏症是指血液25OHD浓度<30 nmol/L(12µg/l),维生素D不足是指25OHD血液浓度为为30-50 nmol/L(12-20µg/l),维生素D充足是指血液浓度为>50 nmol/L(>20µg/l)。而25 nmol/L(10µg/l)是人体健康所需要的临界水平。
生化性骨软化症是指维生素D缺乏症结合碱性磷酸酶(ALP)升高和/或甲状旁腺激素(PTH)升高。由于直到晚期阶段才通过补偿机制维持正常血钙水平,因此未将其作为生化性骨软化症的必要条件。
维生素D缺乏症的非基因检测方法
在临床上,可以采用定量液相色谱串联质谱法(AB Sciex API4000 MS/MS分析仪)测定血清25OHD浓度,也可以采用放射免疫测定法(Roche Cobas C6000)进行测定。进行临床实验测定的实验室接受国家临床医学检验中心的质量抽查与控制。两种方法的批内和批间变异系数(CV)均小于10%。
血清碱性磷酸酶(ALP)活性采用基于染料的测定方法确定,该方法在182 Olympus AU640分析仪上,通过监测在镁存在下p-硝基苯基磷酸盐水解为p-硝基苯酚的速率(在410/480 nm处)来测定酶活性。
采用Immulite 2000 PTH测定法(德国埃尔朗根的西门子医疗诊断产品)测定全段甲状旁腺激素(PTH),这是一种固相、双位点化学发光酶联免疫吸附测定法。ALP和PTH的参考范围是根据CALIPER参考范围和基于制造商推荐的特定测定参考范围综合得出的。
维生素D缺乏症的遗传表现
家庭成员之间的微量营养素摄入量往往相似,并且有证据表明,父母尤其是母亲的饮食不良与后代的饮食不良密切相关,这是遗传性的一个常见证据。根据《维生素D缺乏症的基因解码》,后代的微量营养素缺乏症受母亲教育水平的强烈影响。同样,补充剂的摄入,如儿童维生素D的摄入,也受到母亲因素如年龄和教育程度的影响。年龄和教育程度是影响维生素D缺乏症基因检测接受度的重要因素,也是科学选择基因检测项目的重要因素。不同的基因检测结果对纠下维生素D缺乏症有着明显的差异。在高纬度国家,由于紫外线B(UVB)辐射减少,维生素D缺乏症非常普遍,因为其主要来源是皮肤在UVB暴露后的合成。因此,人们对维生素D补充剂的依赖程度很高。大多数高纬度国家和地区,包括英国中国北方,都需要遵循维生素D补充指南,尤其是在深色皮肤人群等高风险群体中。然而,维生素的摄入量差异很大,这导致了几个高纬度地区营养性佝偻病的流行情况,尤其是那些没有使用按要求使用添加维生素D食品的人群。
维生素D缺乏是儿童营养性佝偻病贼常见的原因之一。维生素D缺乏会导致肠道对钙的吸收减少,从而降低骨骼矿化所需的矿物质供应。骨骼矿化减少(骨软化症)会影响成人和儿童,而儿童还会发展为生长板紊乱的佝偻病。佝偻病不仅表现为骨骼畸形、骨折、生长迟缓和发育迟缓,还可能出现低钙血症并发症,包括癫痫发作、手足搐搦,以及罕见的因扩张型心肌病导致的心力衰竭。佳学基因解码通过一系列基因检测科普文章介绍了儿童维生素D缺乏症的临床表现、发病率和并发症,并通过基因检测明确缺乏症发生的基因因素,从而降低维生素D缺乏症对家庭健康的系列影响,并提高对儿童进行合理看护的意识。
什么样的人应当作维生素D缺乏症?
维生素D缺乏症的的临床表现及检验科检查指标
| 临床表现 | 钙(2.2-2.7mmol/L) | 磷酸盐(0.9–1.8 mmol/L) | ALPIU/L* | PTH(13-29 ng/L ) | 25OHD(>50 nmol/L) |
|---|---|---|---|---|---|
| 扩张性心肌病 (6 月大) | 2.2 | 1.2 | 1060 | 362 | 48.9 |
| 低钙抽搐 (出生后6天) | 1.74 | 3.39 | 530 | 61 | 34.3 |
* 0- 4wk: 50-230 IU/L, 5wk-9y: 80 – 330 IU/L.
佳学基因维生素D缺乏症基因检测应用案例
基因解码基因检测发现,在出现症状性维生素D缺乏症的儿童的家庭成员/家庭成员中,维生素D缺乏和生化性骨软化症的比例非常高。在发现维生素D缺乏症的患者中,其中93%的母亲和79%的兄弟姐妹存在维生素D缺乏症(<30nmol/l或12 µg/l)。多达72%的母亲和96%的兄弟姐妹存在生化性骨软化症,这凸显了这些家庭钙缺乏的严重程度。在有低钙血症的兄弟姐妹中,有10%的人被记录为低钙血症,与维生素D缺乏但血钙正常的兄弟姐妹相比,他们的25OHD水平显著降低,ALP和PTH水平显著升高。与年龄较大儿童的母亲相比,婴儿母亲的25OHD水平显著降低,这表明微量营养素缺乏的典型垂直传播(从母亲到胎儿),以及产前维生素D补充不足对婴儿维生素D状态的直接影响。
维生素D缺乏症的临床表现存在季节性变化。在COVID封锁限制后,维生素D缺乏症的病例有所增加。
发现两名受试者在无显著维生素D缺乏症的情况下出现症状,并怀疑这些患者同时存在钙缺乏症。这两名患者都是婴儿。已知在婴儿中,多达60%的25OHD2或25OHD3可以以其C-3差向异构体形式存在,这可能导致25OHD水平的高估。医院常用的钙测定通常无法区分这些差向异构体,并且可能无法正确反映婴儿的总维生素D状态,从而造成诊断错误。因此,对于婴儿,应谨慎解释25OHD水平,并考虑使用基因检测的方法来评估维生素D状态结合如液相色谱-串联质谱法(LC-MS/MS)。此外,在评估婴儿维生素D状态时,应同时考虑钙摄入量和营养状况。
维生素D缺乏症基因检测案例分析
维生素D缺乏症的一个临床表现是佝偻病。在佳学基因所收录录的佝偻病儿童队列中,包括27名散发性佝偻病儿童(血清25[OH]D浓度均值±标准差为12.1±4.8 ng/mL)和12名来自有多个一级亲属患有佝偻病的家庭(血清25[OH]D浓度为11.4±4.5 ng/mL)的儿童。12例指标病例的22名一级亲属有与佝偻病相符的腿部畸形史,其中14名被纳入佳学基因总结性分析。使用10分制严重程度量表上的佝偻病放射学评分大于1.5来确认所有指标病例和大多数患有佝偻病的兄弟姐妹。对照组由21名19至59个月大(均值±标准差为35.7±11.9个月)的正常儿童组成。检测分析时收集了每位受试者的医疗和人口统计数据,特别强调了与佝偻病相符的骨骼畸形,并测量了骨和矿物质代谢的生化参数。所有参与分析的患者均获得了机构审查委员会的批准,并且在纳入研究之前,所有患者或其父母均签署了书面知情同意书。
在两个家族(家族1和家族2)的两代人中,佳学基因检测在八名受试者中发现了数据库已收录的CYP2R1基因c.296T>C(L99P)突变。该突变与CYP2R1基因座上45kb基因组DNA(gDNA)区域内的一致单倍型处于连锁不平衡状态。在其他10个家族的59名受试者中,均未发现该单倍型,因此它非常罕见。因此,这两个看似无关的山西家庭在突变染色体上的CYP2R1基因座上表现出状态一致性,并可能与数据库记录的另一名亚佝偻病的家族成员中发现的L99P等位基因有共同起源。
家族2中先证者的母亲在CYP2R1基因第3外显子的核苷酸位置726处发生了腺嘌呤(A)被胞嘧啶(C)替代的杂合子突变(c.726A>C)。这一错义突变导致CYP2R1蛋白第242位氨基酸的赖氨酸(K)被天冬酰胺(N)取代(p.K242N)。
在佳学基因收录的59名无关受试者以及1000基因组项目中的628名无关受试者的CYP2R1等位基因中,均未发现L99P和K242N这两种突变,从而排除了所识别的突变代表特定人群序列变异的可能性。此外,亮氨酸99和赖氨酸242在哺乳动物、鸡和鱼类的CYP2R1酶中都是保守的,这表明这些残基在蛋白质功能或结构中发挥着重要作用。
维生素D缺乏症基因解码基因检测使用生物信息学软件Condel对这两种点突变的影响进行了分析,该软件预测L99P和K242N氨基酸替换都是有害的。亮氨酸99的替换被提出会损害CYP2R1的折叠,而佳学基因对K242N突变的计算机模拟分析预测,这种氨基酸替换会干扰相互作用表面。已知脯氨酸是一种会破坏螺旋的氨基酸,亮氨酸99被脯氨酸替换会破坏螺旋的氢键网络和立体结构。赖氨酸242被天冬酰胺替换则被预测会破坏Phe240的定位,从而导致CYP2R1与其底物(前体维生素D)的相互作用减弱。
这些多患者病例的统计学分析表明,基于基因解码的基因检测不仅可以迅速鉴定数据库已收录的基因突变,也可以发现数据库未收录的基因突变,从而对受检者的发病原因进行分析明确。
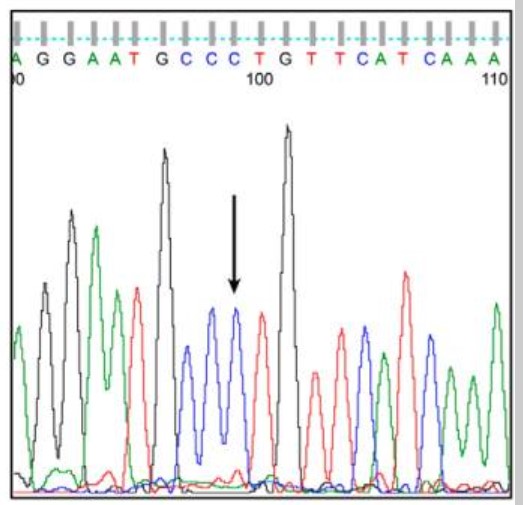
图:这是先证者第2外显子DNA序列色谱图的一部分。每个色谱图上方都标注了CYP2R1的核苷酸序列。这揭示了在第296位(箭头所指)发生了胸腺嘧啶(T)到胞嘧啶(C)的纯合子替换,导致第99位密码子的氨基酸亮氨酸(Leucine)被脯氨酸(Proline)所替代(p.99L>P)
(责任编辑:佳学基因)


