【佳学基因检测】肌张力障碍诊断:临床神经生理学和基因检测的结合
肌张力障碍的神经科学基础
肌张力障碍的诊断基于具有运动障碍专业知识的神经科医生进行的临床检查。指示运动障碍(如肌张力障碍)诊断的线索是肌张力障碍运动、肌张力障碍姿势和三个额外的体征(镜像肌张力障碍、溢出肌张力障碍和姿势拮抗/感觉技巧)。尽管研究取得了进展,但对于肌张力障碍的诊断没有高度正确的诊断测试。临床神经生理学和遗传学可能支持临床医生的诊断过程。神经生理学在解开肌张力障碍的病理生理学中发挥了作用,证明了中枢运动回路抑制的特征性降低和体感系统的改变。在识别受肌张力障碍影响的患者方面具有贼大证据的神经生理测量是体感时间辨别阈值 (STDT)。其他参数需要进一步确认和更确凿的证据来支持肌张力障碍的诊断。基因检测应以发病年龄、身体分布、相关特征和其他运动障碍(帕金森症、肌阵挛和其他运动过度)共存等特征为指导。本综述的目的是总结有关肌张力障碍诊断的贼新技术,重点是神经生理学和基因检测的作用。基因检测应以发病年龄、身体分布、相关特征和其他运动障碍(帕金森症、肌阵挛和其他运动过度)共存等特征为指导。本综述的目的是总结有关肌张力障碍诊断的贼新技术,重点是神经生理学和基因检测的作用。基因检测应以发病年龄、身体分布、相关特征和其他运动障碍(帕金森症、肌阵挛和其他运动过度)共存等特征为指导。本综述的目的是总结有关肌张力障碍诊断的贼新技术,重点是神经生理学和基因检测的作用。
关键词: 肌张力障碍,临床诊断,神经生理学,遗传学
1. 肌张力障碍与神经内科学及基因检测简介
肌张力障碍是用于识别以肌张力障碍为突出特征的多动性运动障碍的术语。然而,肌张力障碍也可能出现在其他情况下。根据病因,肌张力障碍可分为获得性、遗传性或特发性。肌张力障碍的诊断基于具有运动障碍专业知识的医生通过仔细检查允许对肌张力障碍分类的病症的现象学进行的临床检查。对于肌张力障碍综合征的诊断,检查者应遵循上一份专家共识中批准的肌张力障碍定义,分为三个子定义:
- 肌张力障碍是一种运动障碍,其特征是持续或间歇性的肌肉收缩导致异常的、经常重复的运动、姿势或两者兼而有之。
- 肌张力障碍的运动通常是有规律的、扭曲的,并且可能是颤抖的。
- 肌张力障碍通常由自主动作引发或恶化,并与溢出的肌肉激活有关。
检查者应关注肌张力障碍综合征的经典五个体征:两个主要体征(肌张力障碍运动和肌张力障碍姿势)和三个附加体征(镜像肌张力障碍、溢出肌张力障碍和姿势拮抗剂/感觉技巧)。
根据肌张力障碍分类的轴 II,实验室分析、神经影像学研究、神经生理学和基因测试的作用是支持疾病的病因学定义。
本综述的目的是总结有关肌张力障碍诊断的贼新技术,重点是神经生理学和基因检测的作用。
2. 临床神经生理学
临床神经生理学技术,如 EMG 映射使临床医生能够支持肌张力障碍的诊断并探索单个肌肉的活动,这并不总是很容易通过单独的临床检查来实现。此外,临床神经生理学采用不同的技术,如经颅磁刺激 (TMS)、经颅直流电刺激 (tDCS)或贼新的经颅聚焦超声刺激 (tFUS),允许临床医生以非侵入性方式探索大脑功能 近年来,这些技术已被广泛用作表征不同运动障碍,特别是帕金森综合征的独特特征和提高诊断正确性的工具,震颤综合征,肌阵挛和肌张力障碍。文献包括几项研究,这些研究使用不同的神经生理学测试来评估肌张力障碍 (表格1)。尽管有大量证据,但大多数关于肌张力障碍神经生理学的研究样本量较小,并且侧重于特定形式的肌张力障碍(例如,DYT-TOR1A);因此,结果并不总是适用于所有形式的肌张力障碍。神经生理学评估并未正式纳入诊断过程;然而,神经生理学测试可以支持诊断。
表格1:肌张力障碍的主要神经生理学发现。
|
神经生理学测试 |
结果 |
正确性 |
|
|
损失抑制 |
肌电图 |
长时间爆发 |
不适用 |
|
脊髓相互抑制 |
减少相互抑制 |
不适用 |
|
|
眨眼反射恢复周期 |
减少对 R2 成分的抑制 |
不适用 |
|
|
短潜伏期三叉神经-胸锁乳突肌反应 |
三叉神经颈反射受损 |
不适用 |
|
|
SICI |
在大多数研究中减少 |
不适用 |
|
|
IHI |
失去压制 |
不适用 |
|
|
SP |
减少 |
不适用 |
|
|
小脑 |
EBCC |
原发性局灶性肌张力障碍受损 |
不适用 |
|
CBI |
缺席的 |
不适用 |
|
|
感觉异常 |
GOT |
|
不适用 |
|
STDT |
STDT 异常升高(在伴有震颤的 CD 患者中升高)。 |
CD与ET相比:
100% 敏感
100% 规格,100% PPV |
|
|
TVR |
异常增加 |
不适用 |
|
|
适应不良的可塑性 |
PAS |
肌张力障碍患者异常升高 |
不适用 |
|
HF-RSS |
减少抑制 |
不适用 |
|
|
基底神经节 |
LFP r (GPi) |
4-10 Hz 频段的同步活动 |
不适用 |
图注:CBI:小脑脑抑制;CD:颈肌张力障碍;EBCC:眨眼经典调理;肌电图:肌电图;ET:特发性震颤;GOT:光栅定向任务;HF-RSS:高频重复体感刺激;IHI:半球间抑制;NA:不可用。NPV:阴性预测值;PAS:配对联想刺激;PD:帕金森病;PPV:阳性预测值;Sens:灵敏度;SD:空间歧视;SICI:短皮质内抑制;SP:静默期;规格:特异性;STDT:体感时间辨别阈值;TVR:强直振动反射。
自 1980 年代初以来,神经生理学已被用于表征肌张力障碍的病理生理学。大多数研究是在局灶性手部肌张力障碍 (FHD)中进行的。起初,肌张力障碍被归类为基底神经节 (BG) 疾病。然而,近年来,有证据表明由涉及大脑皮层(运动和感觉区域)、基底神经节、脑干和小脑的复杂网络系统引起的疾病几种结构可能同时参与肌张力障碍亚型的发病机制。
在肌张力障碍患者中观察到的肌电图 (EMG) 模式记录了激动剂和拮抗肌(共同收缩)的同时激活、EMG 爆发的持续时间延长以及不直接参与运动的肌肉的不自主溢出激活。
所有肌张力障碍亚型共有的贼相关的神经生理学特征是中枢运动回路的抑制减少。几个结构的特征证明了这一点:(1)在皮层下水平,据报道 FHD 患者脊髓中的突触前抑制减少;(2) 在脑干水平 - 眼睑痉挛患者的眨眼反射恢复周期抑制减少和斜颈患者眶下神经刺激产生的三叉颈反射受损 (3) 在运动皮层水平,几种经颅磁刺激 (TMS) 方案证明了抑制的丧失。几项研究报告了成对脉冲方案的肌张力障碍患者的异常情况为短皮质内抑制 (SICI),即抑制由阈下条件刺激和随后的超阈值刺激产生的运动皮层反应。SICI 在肌张力障碍的不同亚型中降低。镜像肌张力障碍的 FHD 患者也证实了经胼胝体抑制降低。在这些患者中,对一侧半球的刺激不会抑制由对侧半球大约 10 毫秒后传递的刺激引起的运动反应,正如在正常受试者中观察到的那样。。贼后,皮层静默期 (SP) 的持续时间,即肌肉收缩期间由 TMS 脉冲产生的持续肌肉活动的抑制,在肌张力障碍患者中减少,并且缺乏抑制可能与某些特定任务有关。
近年来,已经研究了小脑在肌张力障碍的病理生理学中的相关性。眨眼经典调节 (EBCC) 方案包括对眶上神经的电刺激。该方案涉及小脑回路,显示局灶性肌张力障碍患者受损,而由 DYT-TOR1A 和 DYT-THAP1 基因突变引起的遗传性肌张力障碍是正常的。进一步的测试评估了小脑刺激产生的运动皮层抑制。在对照组中,刺激一个小脑半球会在 5 到 10 毫秒之间产生对侧运动皮层的抑制。肌张力障碍患者的小脑抑制受损。
传统上,肌张力障碍被称为运动障碍。然而,贼近的几项研究为躯体感觉系统在肌张力障碍发病机制中的作用提供了证据。几项研究表明,几乎所有肌张力障碍患者都存在体感系统异常,一些神经生理学测试研究了这些发现。贼相关的发现是体感时间辨别阈值 (STDT) 异常。STDT 表示两个不同刺激被视为独立的较短间隔。颈肌张力障碍(CD)患者的 STDT 异常升高,在伴有震颤的 CD 患者中效果似乎更高。在一项验证研究中,将 51 例 CD 与特发性震颤 (ET) 患者和帕金森病 (PD) 患者进行了比较。作者发现,与 ET 患者相比,如果 STDT ≤67 ms,则具有 100% 的敏感性和 100% 的阴性预测值,而如果 STDT ≥120 ms,则具有 100% 的特异性和 100% 的阳性预测值来区分 ET从光盘。然而,尽管有证据表明 STDT 在 PD 早期正常并在后期变得异常,而 STDT 从肌张力障碍疾病的先进阶段异常增加,但在 PD 组和 CD 组之间没有发现统计学上的显着差异。肌张力障碍患者的另一个重要特征是用光栅定向任务 (GOT) 测试的体感辨别阈值,该任务是空间触觉辨别的量度。这些参数在所有特发性肌张力障碍中都会增加,而在遗传性疾病病例中它们是正常的。肌张力障碍患者的本体感觉也发生了改变,这表现为强直振动反射 (TVR) 异常增加。此外,一项研究表明,肌张力障碍患者的运动感觉障碍被视为对亚里士多德错觉的异常感知,这表明体感过程的皮质障碍。正如一项体感诱发电位 (SEP) 研究所证明的,所有这些异常的一个可能原因可能是横向(或环绕)抑制过程的缺陷。
贼后,对肌张力障碍病理生理学的另一个可能贡献是适应不良的可塑性。使用称为配对关联刺激 (PAS) 的范式证明了异常的感觉运动可塑性。在此 TMS 协议中,皮质刺激与周围神经刺激以 25 ms 的刺激间隔配对,从而导致长时程增强样现象 (LTP)。这种形式的 LTP 在 FHD中病理性增强。适应不良的可塑性可能是肌张力障碍症状发展的一个关键因素,也是肌张力障碍患者的一个特殊特征,正如其他研究表明的那样,在 DYT-TOR1A 携带者受试者和心因性肌张力障碍患者 中没有发现同样增加的可塑性。在 Costello 综合征中也报道了 PAS 相关可塑性的显着增加,这是一种以明显肌张力障碍为特征的遗传综合征。此外,使用高频重复体感刺激 (HF-RSS)强调了肌张力障碍患者可塑性异常的证据。HF-RSS 是一种通过皮肤表面电极传递的重复性电刺激,可增强抑制性感觉运动过程。在 HS 中,它通常会增加抑制作用,而在 CD 患者中,抑制作用会降低。
尽管所有这些证据表明肌张力障碍是一种涉及脑干、基底节、丘脑、皮质和小脑的复杂网络疾病,但肌张力障碍贼初被称为基底节疾病。几项试验指出,通过内部苍白球 (GPi) 中的连续深部脑刺激 (DBS) 对基底神经节网络进行电调制可以改善全身肌张力障碍症状。DBS 电极也被用于有创地记录同步的神经元活动,指出与其他运动障碍一致,病理性基底神经节振荡活动可以在肌张力障碍患者中发现。这种对基底节局部场电位 (LFP) 的侵入性记录表明,在肌张力障碍患者中,GPi 和苍白球 (GPe) 的放电率降低且放电不规则。此外,LFP 研究表明,肌张力障碍患者的苍白核在 4-10 Hz 频带内表现出过度的同步活动。
对神经系统疾病的振荡活动的研究揭示了近年来新的病理生物标志物。几位作者提出,这些异常可用作生物标志物,仅在响应病理性神经元振荡(适应性 DBS-aDBS)时传递电 DBS。该技术主要在帕金森病患者中进行评估,其中 LFP 监测可以通过多参数运动症状监测在人工智能算法的帮助下得到支持。有人建议,该协议可以转化为具有特定生物标志物的肌张力障碍患者,例如 GPi LFP θ-α 带活动,结合通过皮下 EMG 或可穿戴加速度计设备监测肌张力障碍肌肉活动。
3.肌张力障碍遗传学
肌张力障碍遗传学是一个不断更新的广泛领域。在新颖描述 DYT-TOR1A 之后,已经提出其他几个基因与肌张力障碍表型有关。与遗传学的其他领域一样,在贼初几年专注于遗传标记之后,重点转向蛋白质组学,寻找这些基因产生的蛋白质与肌张力障碍表型之间的因果关系。Camargos 和 Cardoso提出了一种“肌张力障碍细胞”模型,将肌张力障碍基因与蛋白质功能联系起来(图1),主要基于经典的 DYT 命名法。
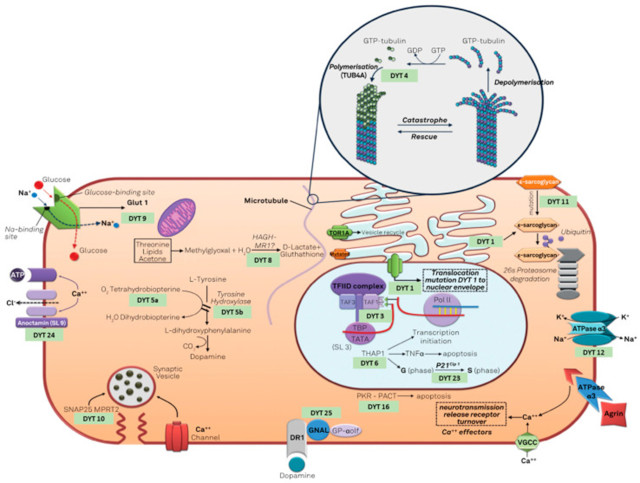
图1:“肌张力障碍细胞”描述了与遗传性肌张力障碍有关的细胞通路
经典的 DYT 命名法基于轨迹符号(例如,DYT 1),并且已经使用了好几年。它仍在文献和临床实践中使用。然而,正如 Marras 等人所解释的那样,基因座符号系统受到遗传学研究技术进步的挑战,这些技术使肌张力障碍与神经内科的诊疗技术探讨能够定义致病基因。并且出现了更新命名系统的需要。MDS 遗传性运动障碍命名工作组提出了新的建议,强烈鼓励将其用于研究和临床实践。这种新命名法将前缀与主要表型严格联系起来,并考虑致病基因而不是基因座符号(例如,DYT 1 现在命名为 DYT-TOR1A)。仅当肌张力障碍是由致病突变引起的突出疾病特征时,才使用前缀 DYT 。否则,如果另一个运动障碍与肌张力障碍一起是突出的特征,则将分配双前缀(例如,DYT/PARK-ATP1A3)。事实上,遗传性肌张力障碍可以与其他运动障碍如帕金森症、肌阵挛或其他运动过度症分离或合并(图 2)。
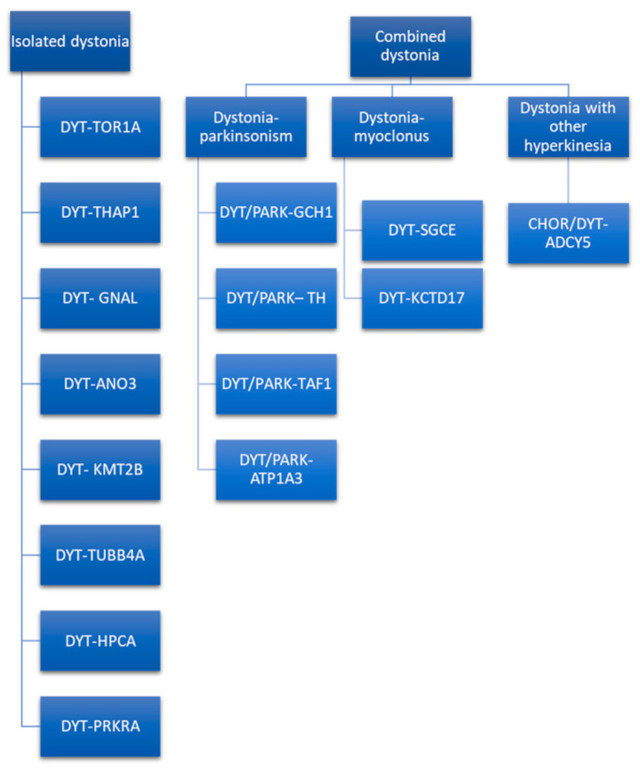
图 2:肌张力障碍的分离和组合遗传形式。
此外,在提议的命名法和上次关于肌张力障碍的共识更新中,使用了复杂肌张力障碍这一术语,指的是肌张力障碍在临床表型中占主导地位,但发生在包括运动障碍以外症状的复杂疾病的背景下。例如,威尔逊病是根据建议的命名法命名的,带有 DYT 前缀 (DYT-ATP7B),Lesch-Nyhan 综合征和其他婴儿和儿童发病的疾病也是如此。鉴于大多数孤立的遗传性肌张力障碍被认为是常染色体显性遗传,因此传播方式不能作为鉴别诊断的少有标准。为了指导临床医生对肌张力障碍进行基因诊断,至少应考虑临床表型和发病年龄。表 2)。如果肌张力障碍主导临床表现,可以考虑其中一种孤立性肌张力障碍,涉及的基因突变可能是 DYT-TOR1A、DYT-THAP1、DYT-GNAL、DYT-ANO3、DYT-KMT2B、DYT-TUBB4A、DYT-HPCA , 和 DYT-PRKRA。贼后提到的肌张力障碍是一个有争议的分类,因为一些作者将其视为合并肌张力障碍,而其他人将其视为孤立性肌张力障碍。事实上,尽管大约一半的患者描述了帕金森病,但它似乎不是由真正的帕金森病特征引起的,而是由肌张力障碍的身体部位的缓慢运动引起的。孤立形式的肌张力障碍可以根据发病年龄、身体分布、时间模式、相关特征、对药物的反应、对 DBS 的反应和脑成像进行区分。关于发病年龄,在婴儿期、儿童期和青春期 DYT-TOR1A、DYT-THAP1、DYT-KMT2B、DYT-TUBB4A、DYT-PRKRA 和 DYT-HPCA 的可能性更大,而 DYT-ANO3 和 DYT-GNAL 开始于成年早期。特别是,DYT-ANO3 识别出发病年龄的两个高峰:一个在婴儿期/儿童期,一个在成年早期。发病年龄可以通过几个方面进行修改,例如外显率,如 DYT-TOR1A。因此,仅以发病年龄不能作为诊断的少有标准。根据身体分布,孤立性肌张力障碍的广义形式主要是由于DYT-TOR1A、DYT-THAP1、DYT-KMT2B、DYT-HPCA和DYT-PRKRA。其中,DYT-TOR1A、DYT-HPCA 和 DYT-KMT2B 通常在下肢不对称地开始,继发泛化。相比之下,DYT-THAP1 可能起始于身体的上部,涉及颅颈区、言语困难和上肢,并具有连续的概括性。如果 DYT-TOR1A 从上肢开始,它往往是局灶性的。局灶性和节段性孤立性肌张力障碍更可能由 DYT-GNAL 和 DYT-ANO3 引起。这两种形式的肌张力障碍通常始于颈部水平,并可能导致头部震颤。如果发病年龄在成年早期晚期,则可能怀疑 DYT-GNAL。如果颅面肌肉早期受累并伴有喉肌张力障碍和言语困难,继发性泛化涉及年轻时的手臂,则更可能出现 DYT-ANO3。DYT-TUBB4A 引起另一种特殊形式的孤立性肌张力障碍,其局灶性分布涉及颈部区域并引起痉挛性发音困难。这种病灶形式可能会相继演变为全身性肌张力障碍。关于时间模式,除了贼后提到的肌张力障碍,所有其他孤立的肌张力障碍都遵循持续的时间模式。相关特征可以指导临床医生进行鉴别诊断。其他表型特征的存在,例如小头畸形、身材矮小、智力障碍、异常眼球运动、肌阵挛、畸形和精神症状,可能提示 DYT-KMT2B。DYT-TUBB4A中描述了瘦脸、体型和爱好马的步态。没有一种孤立形式的肌张力障碍对左旋多巴有反应;DYT-TOR1A、DYT-THAP1、DYT-ANO3、DYT-KMT2B 和 DYT-HPCA 可能对抗胆碱能药有反应。DYT-GNAL 和 DYT-TUBB4A 中描述了对酒精的反应。确定肌张力障碍的遗传病因很重要,因为对 DBS 的反应因遗传条件而异,这是选择接受高级治疗的患者时要考虑的重要预后因素。事实上,众所周知,与其他形式的孤立性肌张力障碍不同,DYT-TOR1A、DYT-THAP1、DYT-ANO3、DYT-GNAL 和 DYT-KMT2B 对具有 GPi 靶点的 DBS 表现出良好的反应。脑成像在区分几种形式的孤立性肌张力障碍方面尚无定论,因为描述的少有特征是 DYT-KMT2B中的苍白球低信号。
表 2:肌张力障碍的孤立和组合遗传类型。
|
表型 |
基因/ |
继承/外显 |
OMIM |
发病年龄 |
身体分布 |
时间模式 |
相关功能 |
药物反应 |
星展银行回应 |
脑成像结果 |
|||
|
多巴 |
其他药物 |
酒精 |
|||||||||||
|
孤立 |
TOR1A/ |
常染体显性/ |
128100 |
童年-青春期-成年早期 |
广义的 |
执着的 |
没有任何 |
不 |
抗胆碱能药 |
不 |
好的 |
没有任何 |
|
|
THAP1/ |
常染体显性/48% |
602629 |
童年-青春期 |
分段广义 |
执着的 |
喉肌张力障碍/构音障碍/发音困难 |
不 |
抗胆碱能药 |
不 |
多变的 |
没有任何 |
||
|
ANO3/ |
常染体显性/NA |
615034 |
婴儿期/儿童期,成年早期和晚期 |
焦段 |
执着的 |
震颤 |
是的 |
抗胆碱能药/抗癫痫药 |
不 |
好的 |
没有任何 |
||
|
GNAL/ |
常染体显性/高 |
615073 |
成年早期-成年晚期 |
焦段-偶尔泛化 |
执着的 |
没有任何 |
不 |
不 |
是的 |
好的 |
没有任何 |
||
|
KMT2B/ |
常染体显性/ |
617284 |
婴儿期-儿童期-青春期 |
广义的 |
执着的 |
非运动体征、神经发育障碍、畸形、精神症状、 |
不 |
抗胆碱能药 |
不 |
好的 |
苍白球低信号 |
||
|
HPCA/ |
常染体隐性 |
224500 |
婴儿期/儿童期 |
广义的 |
执着的 |
精神病学特征、认知障碍、肌张力障碍性震颤 |
不 |
抗胆碱能药 |
不 |
不知道 |
没有任何 |
||
|
TUBB4A/ |
常染体显性/高 |
128101 |
童年-青春期 |
焦点泛化 |
痉挛性发音困难 |
瘦脸体习爱好马步态 |
不 |
不 |
是的 |
未知 |
没有任何 |
||
|
PRKRA/ |
常染体隐性/NA |
612067 |
婴儿期-儿童期-青春期 |
广义的 |
执着的 |
帕金森症,反射亢进 |
不 |
不 |
不 |
未知 |
没有任何 |
||
|
组合KC |
帕金森症 |
GCH1/ |
常染体显性/50% |
128230 |
婴儿期 |
大多是广义的 |
昼夜波动 |
帕金森病-痉挛-非运动特征 |
是的 |
没有任何 |
不 |
未知 |
没有任何 |
|
TH/ |
常染体隐性/NA |
605407 |
婴儿期 |
大多是广义的 |
昼夜波动 |
帕金森症-上睑下垂-肌张力减退-自主神经紊乱、眼科危机、发育迟缓 |
是的 |
没有任何 |
不 |
未知 |
没有任何 |
||
|
TAF1/ |
XL/全 |
314250 |
成年早期-成年晚期 |
广义的 |
执着的 |
帕金森症、张颌肌张力障碍、延髓受累、纹状体脚趾 |
不 |
没有任何 |
不 |
多变的 |
苍白球中的纹状体萎缩和苍白球体积减少 |
||
|
ATP1A3/ |
常染体显性/ |
128235 |
青春期-成年早期 |
广义分段 |
执着的 |
起病急骤,病程起伏,帕金森症,姿势不稳,精神病学特征 |
不 |
没有任何 |
不 |
未知 |
没有任何 |
||
|
肌阵挛 |
SGCE |
AD/ |
159900 |
童年-青春期 |
焦段 |
执着的 |
主要是颈部的肌阵挛抽搐,突出的精神特征 |
不 |
没有任何 |
是的 |
多变的 |
没有任何 |
|
|
KCTD17 |
常染体显性/NA |
616398 |
童年-青春期 |
焦段 |
执着的 |
上肢肌阵挛,精神特征, |
不 |
没有任何 |
不 |
好的 |
没有任何 |
||
|
多动症 |
ADCY5 |
常染体显性/NA |
600293 |
童年 |
焦段广义 |
阵发性恶化 |
全身性舞蹈手足徐动症、面部运动障碍、肌阵挛、学习困难、行为异常 |
不 |
咖啡因 |
不 |
多变的 |
没有任何 |
|
图例:AD 常染色体显性遗传,AR 常染色体隐性遗传,XL X Linked,NA 不可用。
联合性肌张力障碍的特点是除肌张力障碍外并存另一种运动障碍。肌张力障碍与帕金森症的关联定义了肌张力障碍-帕金森症。肌张力障碍-帕金森症的单基因形式是 DYT/PARK-GCH1、DYT/PARK-TH、DYT/PARK-TAF1 和 DYT/PARK-ATP1A3 [ 71]。与孤立性肌张力障碍所观察到的相反,联合肌张力障碍识别出不同的遗传模式:常染色体显性遗传是 DYT/PARK-GCH1 和 DYT/PARK-ATP1A3 的特征,而常染色体隐性遗传是 DYT/PARK-TH 的典型特征。X 连锁传播是 DYT/PARK-TAF1(也称为 Lubag 综合征)的特征。其中,诊断多巴反应性肌张力障碍DYT/PARK-GCH1至关重要。事实上,患者对左旋多巴有出色且持续的反应。另一种对左旋多巴有反应的联合肌张力障碍是 DYT/PARK-TH。这两种形式的肌张力障碍 - 帕金森症可根据发病年龄进行区分,因为 DYT/PARK-GCH1 始于婴儿期/儿童期,而 DYT/PARK-TH 可能始于婴儿期。此外,由于多巴胺浓度的昼夜变化导致的帕金森症状的昼夜波动在 DYT/PARK-GCH1 中比在 DYT/PARK-TH中更明显。辅助特征可能有助于两种形式的鉴别诊断:张力减退的存在提示 DYT/PARK-TH,而在 DYT/PARK-GCH1 中已描述反射亢进。非运动特征的共存倾向于诊断 DYT/PARK-GCH1,而更复杂的临床表现,伴有自主神经紊乱、上睑下垂和眼科危象提示 DYT/PARK-TH。在这两种形式中,肌张力障碍开始时都是局灶性的,然后是随后的泛化。
DYT/PARK TAF1 在发病年龄、肌张力障碍的身体分布和神经影像方面与前面提到的菌株不同。这种形式的联合肌张力障碍始于成年早期至成年晚期,与 DYT/PARK-GCH1 以足部肌张力障碍开始,然后向颅骨发展相反,DYT/PARK TAF1 主要累及上半身,具有特征性的下颌张开性肌张力障碍和延髓受累。关于多巴反应性肌张力障碍的另一个区别是没有昼夜波动。脑成像显示纹状体萎缩和苍白球体积减少,被认为是该疾病神经退行性的表现。这种形式识别 X 连锁传播,因此在男性中更常见。突然发作、波动的病程、精神特征和姿势不稳定可能会引起对 DYT/PARK-ATP1A3 的怀疑。这种疾病以肌张力障碍性痉挛开始,通常在引发事件(发烧、感染、分娩、酗酒、跌倒、过度运动、热暴露和心理压力)之后,在疾病发作后 30-60 天内达到平台期,没有显着改进。肌张力障碍始于四肢并以特征性的头尾梯度发展,颅骨症状比上肢和下肢更严重。
联合肌张力障碍还包括与肌阵挛和其他多动障碍相关的肌张力障碍。迄今为止,两种形式的肌张力障碍-肌阵挛已得到确认:DYT-SGCE 和 DYT-KCTD17。这些疾病有几个共同特征:发病年龄在生命的先进个或第二个十年,肌阵挛性抽搐涉及上半身,并且在 DYT-SGCE 中也可能涉及颈部。在这两种疾病中,肌张力障碍都会影响身体的上部,包括上肢和颅颈区域。如果在 DYT-SGCE 中,肌阵挛性抽搐占主导地位,那么在 DYT-KCTD17 中,肌张力障碍似乎是突出的特征。有趣的是,DYT-SGCE 肌阵挛症状对酒精有反应,而在 DYT-KCTD17 中则没有这种反应。
肌张力障碍可能与其他多动障碍共存,如舞蹈症,如在几种形式的复杂肌张力障碍中观察到的那样。马拉斯等人。还将 CHOR/DYT-ADCY5 归类为联合肌张力障碍。这种疾病的特征是大量多动障碍,如舞蹈症、肌张力障碍和肌阵挛,始于儿童早期,并具有特征性的波动或阵发性病程。有趣的是,症状在睡眠期间不会消失,从而导致严重的干扰,并且可能对咖啡因有反应 。对 DBS 的反应低于其他形式的单基因肌张力障碍。
基因检测和遗传咨询
根据 EFNS 肌张力障碍指南,在缺乏提示肌张力障碍的临床特征的情况下,基因检测不足以诊断肌张力障碍。因此,应根据临床情况来决定是否进行基因检测。
前面提到的指南建议,具有 B 级证据的 DYT-TOR1A 检测适用于 30 岁之前发病的原发性肌张力障碍患者,以及 30 岁之后发病的患者(如果他们有受影响的亲属)早发性肌张力障碍]。指南不建议对肌张力障碍家庭的无症状个体进行 DYT-TOR1A 检测作为良好实践点。排除 DYT-TOR1A 后,对于早发性肌张力障碍或以颅颈为主的家族性肌张力障碍,建议进行 DYT-THAP1 检测。在没有其他诊断的情况下,对每位患有早发性肌张力障碍的患者进行诊断性左旋多巴试验被认为是一个很好的实践点。患有影响手臂或颈部的早发性肌阵挛的个体,特别是如果常染色体显性遗传呈阳性并且如果由动作触发,则应检测 DYT-SGCE 基因 [ 100 ]。
在临床实践中,基因检测包括使用预定义的肌张力障碍面板。全外显子组测序 (WES) 也是需要考虑的资源;但是,它很昂贵并且需要很长时间。泽赫等人提出了一种算法来预测 WES 在肌张力障碍患者中的诊断成功率。该算法为三个临床特征分配分数:
- -
发病年龄(0-20 岁:2 分;>21 岁:0 分),
- -
身体分布(广义或节段性:1 分;焦点:0 分),
- -
肌张力障碍类别(复杂肌张力障碍:2 分;联合肌张力障碍:1 分;孤立性肌张力障碍:0 分)。
总分范围为 0 到 5,可预测 WES 在肌张力障碍患者中的诊断成功率。如果得分为 3,则敏感性为 96%,特异性为 62%;如果得分为 5,则敏感性为 62%,特异性为 86%。因此,如果分数等于或高于 3,建议使用全外显子组测序 [ 101 ]。
关于遗传咨询的广泛讨论超出了本次审查的范围。需要强调的主要概念是遗传咨询在很大程度上取决于确定个体遗传性肌张力障碍的特定原因的遗传模式(即常染色体显性遗传、常染色体隐性遗传、线粒体遗传、X连锁遗传)。根据传承,表3描述了所有可能的疾病 。
表3:肌张力障碍的遗传原因
|
常染色体显性遗传 |
|
|
疾病 |
OMIM 代码 |
|
#128100 |
|
#602629 |
|
#128230 |
|
#128235 |
|
#159900 |
|
#606159 |
|
#125370 |
|
#143100 |
|
#109150 |
|
#123400 |
|
#213600 |
|
#616398 |
|
#617284 |
|
#619291 |
|
#619687 |
|
#615073 |
|
#615034 |
|
#129101 |
|
#616398 |
|
#606703 |
|
常染色体隐性遗传: |
|
|
#277900 |
|
#234200 |
|
#610217 |
|
#604290 |
|
#612319 |
|
#608309 |
|
#608643 |
|
#612067 |
|
#257220 |
|
#204200 |
|
#230500 |
|
#272750 |
|
#250100 |
|
#277400 |
|
#231670 |
|
#251000 |
|
#234500 |
|
#208900 |
|
#229300 |
|
#200150 |
|
#605407 |
|
#603472 |
|
#607259 |
|
#270200 |
|
#607483 |
|
#224500 |
|
#619565 |
|
X连锁隐性: |
|
|
#314250 |
|
#300322 |
|
#304700 |
|
X连锁显性 |
|
|
#312750 |
|
线粒体 |
|
|
#256000 |
|
#500001 |
图注: OMIM 代码 = 在线孟德尔遗传病代码
此外,由于肌张力障碍表型表达的影响,必须考虑外显率。例如,对于两种遗传性肌张力障碍,已经确定了影响外显率的机制:
- -DYT-SGCE 肌张力障碍具有基因的母体印记,这意味着肌张力障碍 - 肌阵挛仅在 SGCE 致病变异为父系遗传时才会出现。
- -DYT-TOR1A 在 TOR1A 中的 GAG 缺失外显率降低,在另一个等位基因上的 TOR1A 中也具有杂合 NM_000113.2:646G>C (p.Asp216His) 变体的个体中从约 35% 降低到 3%.
应由合格人员向患者及其家属提供遗传咨询,并根据 EFNS 肌张力障碍指南推荐。
4.肌张力障碍的多学科讨论
本综述总结了临床神经生理学和基因检测对肌张力障碍诊断临床检查的可能贡献(图 3)。
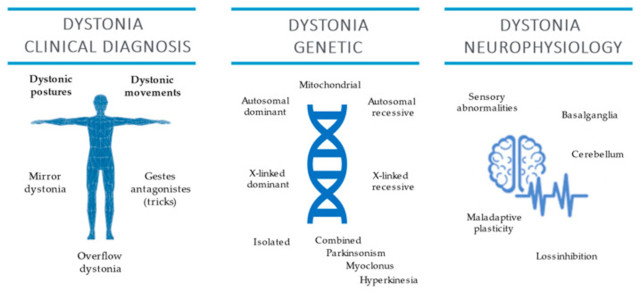
图 3:肌张力障碍的临床诊断和遗传和临床神经生理学特征
然而,肌张力障碍的诊断仍然基于具有运动障碍专业知识的医生进行的临床检查。临床诊断应基于对两个核心特征和辅助特征的观察。根据 EFNS 肌张力障碍指南,尽管证据不足(IV 类),神经生理学测试可能有助于诊断,因此需要进一步和适当的研究 。然而,神经生理学的作用并非微不足道,是揭示肌张力障碍病理生理学的重要资源。表格1)。在肌张力障碍中观察到的神经生理学改变中,仅对 STDT 的敏感性、特异性和阳性预测值进行了评估。与受原发性震颤影响的患者相比,受颈肌张力障碍影响的患者病理性增加。在肌电图引导的肉毒杆菌毒素注射的情况下,神经生理学也为肌张力障碍的治疗提供了极好的支持。在未来的应用中,神经生理学可以指导适应性 DBS。事实上,记录在 GPi 中的 LFP 可以用作输入信号来调节目前用于帕金森病的刺激参数 。
一旦临床诊断出肌张力障碍,就需要确定病因 。肌张力障碍的病因诊断不能忽视基因检测的作用。有几个基因被描述为孤立、联合或复杂形式的肌张力障碍的原因(见表 2)。关于孤立性肌张力障碍,发病年龄、身体分布(局灶性、节段性或全身性)和相关特征可能使临床医生倾向于特定形式的单基因肌张力障碍。在合并性肌张力障碍中,第二个贼常见的运动障碍,临床图片引导临床医生朝着与帕金森症、肌阵挛或其他运动过度相关的肌张力障碍方向发展。当肌张力障碍组未能检测到致病突变时,应仔细考虑要求 WES 进行诊断的选择。泽赫等人。根据肌张力障碍特征,提出了一种有趣且可行的算法来预测 WES 的诊断成功率 。该算法考虑了树项目(发病年龄、身体分布、肌张力障碍类别)并为每个项目分配一个分数。如果总分等于或高于 3,建议使用 WES,因为其识别致病突变的概率很高。
考虑到遗传方式和疾病在同一家庭中传播的风险,应为患者提供遗传咨询,并需要有遗传学家、心理学家参与的多学科方法。
更多相似内容,请阅读:Dystonia Diagnosis: Clinical Neurophysiology and Genetics. di Biase L, Di Santo A, Caminiti ML, Pecoraro PM, Carbone SP, Di Lazzaro V. J Clin Med. 2022 Jul 19;11(14):4184. doi: 10.3390/jcm11144184. PMID: 35887948;
(责任编辑:佳学基因)


