【佳学基因检测】鱼鳞病基因检测揭示哪些患者可以采用一经济有效疗法
遗传性鱼鳞病的精准治疗基因检测
关于遗传性鱼鳞病患者的维生素 D 状态的数据很少,而且对于遗传亚型也不具体。鱼鳞病精准用药基因检测确定了 87 名鱼鳞病患者的血清 25-羟基维生素 D3 (25(OH)D3) 水平;另外还对 69 名患者进行了甲状旁腺激素分析。角化病性鱼鳞病 ( n = 17;中位数 25(OH)D3:10.5 ng/ml)、多色鱼鳞病 ( n = 2;7.0 ng/ml) 和罕见综合征亚型 ( n = 3;7.0 ng/ml) 中维生素 D 缺乏的情况很明显。 TG1 功能正常的板层状鱼鳞病 ( n = 15; 8.9 ng/ml)、TG1 缺陷的板层状鱼鳞病 ( n = 12; 11.7 ng/ml)、先天性鱼鳞病样红皮病 ( n = 13; 12.4 ng/ml)、Netherton 综合征 ( n = 7; 10.7 ng/ml) 和 X 连锁鱼鳞病 ( n = 8; 13.9 ng/ml) 患者的维生素 D 水平降低。寻常型鱼鳞病的 25(OH)D3 水平较高 ( n = 10; 19.7 ng/ml)。12 名患者的甲状旁腺激素升高。25(OH)D3 水平低与鳞屑严重程度高有关 ( p = 0.03),表明鳞屑是维生素 D 缺乏的危险因素。因此,鱼鳞病基因解码基因检测建议筛查和替代维生素 D 缺乏作为鱼鳞病确诊后的精准治疗所需要的额外检测。
《鱼鳞病基因检测揭示哪些患者可以采用一经济有效疗法》关键词:
鱼鳞病, 维生素D缺乏, 甲状旁腺激素
为什么要探索鱼鳞病的精准治疗基因检测?
遗传性鱼鳞病是单基因角化疾病,由影响表皮屏障功能的基因缺陷引起,并与经表皮失水增加有关。稳态修复过程补偿了经表皮失水,导致临床上明显的脱屑和角化过度,并与表皮增生或滞留性角化过度有关 (。屏障缺陷和表皮修复机制引起的明显炎症是大多数类型的常染色体隐性先天性鱼鳞病 (ARCI)、角化病性鱼鳞病 (KPI)(包括表皮松解性鱼鳞病 (EI) 和浅表表皮松解性鱼鳞病 (SEI))和许多综合征形式(如 Netherton 综合征 (NTS))的典型特征。
鱼鳞病精准用药基因检测收集了 87 名遗传性鱼鳞病患者的临床数据,并分析了 25-羟基维生素 D3 (25(OH)D3) 和甲状旁腺激素的血清水平。这些测量是在鱼鳞病常规补充维生素 D 之前进行的。维生素 D 缺乏和不足在鱼鳞病精准用药基因检测队列中非常普遍。不到 10% 的患者维生素 D 水平充足。此外,维生素 D 缺乏与鳞屑的临床严重程度有关。因此,鱼鳞病精准用药基因检测支持我们最近的鱼鳞病指南,该指南建议筛查和补充维生素 D 缺乏症。
鱼鳞病精准用药基因检测基础知识
人体中,表皮是维生素 D 生成的主要来源。维生素 D 由 7-脱氢胆固醇通过光化学方式合成,而 7-脱氢胆固醇是表皮胆固醇生物合成后期步骤中的中间体。在 UVB 光的影响下,7-脱氢胆固醇在非酶促反应中光解为真皮血管中结合的维生素 D3 前体,再与维生素 D 结合蛋白结合。7-脱氢胆固醇从真皮血管中被运输到肝脏,并在那里转化为 25-羟基维生素 D3(25(OH) D3;胆钙化醇;维生素 D3)。该代谢物随后在肾脏中转化为 1α,25-二羟基维生素 D3(骨化三醇),后者是维生素 D3 的生物活性形式。严重维生素 D 缺乏症的典型表现是骨软化症。近期,许多疾病(包括心血管疾病、代谢综合征、某些类型的癌症、易感染疾病、阿尔茨海默病和特应性皮炎)都与维生素 D 缺乏有关。维生素 D3 在人体中起激素原的作用,与先天性和适应性免疫有关。编码抗菌肽抗菌肽CAMP是一种靶基因,可通过局部应用维生素 D 衍生物(如卡泊三醇)来增加其在人体皮肤中的表达。
迄今为止,关于鱼鳞病患者维生素 D 状况的数据很少,而且大多数数据不具体针对遗传亚型。鱼鳞病的发病原因及遗传性基因解码仅针对个案或少数选定患者。据基因解码,板层状鱼鳞病儿童在口服类维生素 A 治疗后出现佝偻病的表现。此外,一项鱼鳞病的发病原因及遗传性基因解码系统地评估了鱼鳞病患者队列中的维生素 D 状况。该鱼鳞病的发病原因及遗传性基因解码还确定,脱屑严重程度是一个独立的危险因素,可能是通过物理阻断紫外线 (UV) 光穿透来实现的。在印度鱼鳞病患者队列中发现,色素沉着严重的皮肤(IV 型和 V 型皮肤)与维生素 D 缺乏之间存在关联。
目前尚不清楚哪种鱼鳞病是维生素 D 缺乏症的最大风险因素。这项观察性、前瞻性的单中心鱼鳞病的发病原因及遗传性基因解码针对 87 名患有遗传性鱼鳞病的患者,重点鱼鳞病的发病原因及遗传性基因解码了遗传性 ARCI。该鱼鳞病的发病原因及遗传性基因解码确定了未接受维生素 D 替代治疗的患者的 25(OH)D3 血清水平。该鱼鳞病的发病原因及遗传性基因解码还分析了甲状旁腺激素 (PTH),以排除由于 PTH 水平异常导致的维生素 D 变化,并分析维生素 D 缺乏症患者是否患有继发性甲状旁腺功能亢进症。该鱼鳞病的发病原因及遗传性基因解码还评估了鳞屑严重程度作为鱼鳞病可能的独立风险因素的重要性。
鱼鳞病基因检测数据库收纳的患者
该鱼鳞病的发病原因及遗传性基因解码总共招募了 87 名患者,他们在德国明斯特大学医院接受了 2 名皮肤病专家 (HT 和 VO) 的仔细临床检查。
所有患者均接受了红斑临床鱼鳞病的发病原因及遗传性基因解码,红斑从无到重度评分(0-3;0:无;1:轻度;2:中度;3:重度)。为了描述鳞屑的严重程度,我们采用了 5 点医生综合评估,该评估在层状鱼鳞病临床试验中使用。鱼鳞病鳞屑和角化评分 (SCSI) 涵盖了角化程度以及受影响的体表面积 (BSA)。
遗传分析
患者接受了进一步的诊断程序以分析鱼鳞病的遗传亚型。因此,所有诊断为寻常型鱼鳞病 (IV) 的患者都通过限制性酶分析了丝聚蛋白 ( FLG ) 基因突变情况以及典型的超微结构和/或免疫组织学特征。对于 X 连锁鱼鳞病 (XLI) 患者,通过生化方法确认类固醇硫酸酯酶缺乏症,这些方法包括直接检测血液中的 STS 活性或检测典型的代谢物特征,例如血清中高水平的氧固醇硫酸盐。对于 ARCI 患者,会常规进行皮肤活检,并通过原位监测谷氨酰胺转氨酶-1 (TG1) 活性对冷冻切片进行TG1 缺乏症检测。此外,从大多数 ARCI 患者的外周血淋巴细胞中分离出基因组 DNA,并进行 PCR 扩增、Sanger 测序或 NGS 方法。对于 KPI 组,进行了组织学和/或超微结构表征,以强调KRT1、KRT10或KRT2突变。对于 NTS 患者,通过免疫组织学证明 LEKTI 缺乏以及通过分子分析检测到SPINK5突变来确诊临床诊断。对于所有其余病例,包括角膜炎鱼鳞病耳聋 (KID) 综合征,进行了基因分析。
血清分析
为测定维生素 D 状态(血清 25(OH) D3 浓度)和 PTH 水平,通过静脉穿刺采集患者血样并立即离心。将血清分装、储存在 −70°C 下,并在常规医院实验室(明斯特大学医院实验室医学中心)使用市售免疫测定法进行分析。使用竞争性化学发光免疫分析法(CLIA,DiaSorin Deutschland,德国迪岑巴赫)在 Liason 自动分析仪上测定 25(OH)D3 浓度。批内和批间变异分别 < 4.0% 和 < 7.0%。使用直接 CLIA(西门子,德国埃施伯恩)在 Immulite 2000 自动分析仪上测定完整甲状旁腺激素的浓度。批内和批间变异性 < 4.2% 和 < 8.8%。
维生素 D 缺乏症定义为血清 25(OH) D3 水平 < 10 ng/ml,维生素 D 不足定义为 10–29.9 ng/ml。正常和充足水平定义为 ≥ 30 ng/ml。毒性水平为 ≥ 100 ng/ml。甲状旁腺功能亢进症定义为血清 PTH 水平 ≥ 65 pg/ml。虽然所有 87 名患者都测量了维生素 D 水平,但只有 69 名患者测定了 PTH 水平。PTH 不足值在所有基因亚型中分布均匀。
统计分析
所有数据分析均采用 SPSS 26 版(适用于 Windows 和 Excel 的统计分析软件)进行。连续参数显示为中位数和范围 [最小值 - 最大值],分类参数显示为绝对频率和相对频率。连续参数的组间比较采用 Mann-Whitney U或 Kruskal-Wallis 检验(> 2 组)。相关性采用 Spearman 等级相关系数评估。推论统计旨在探索性,并据此进行解释。双侧p值 ≤ 0.05 被认为具有统计学意义。
鱼鳞病基因检测分析结果
队列临床数据
在 87 名鱼鳞病患者的鱼鳞病的发病原因及遗传性基因解码队列中,10 名患者被诊断为 IV,8 名患有 X 连锁鱼鳞病 (XLI),42 名患有 ARCI,其中 2 名患有严重亚型多色鱼鳞病 (HI),17 名患有 KPI,7 名患有 NTS (表I)。其他诊断包括 KID 综合征 ( n = 1)、线状角化病-先天性鱼鳞病-硬化性角化病 (KLICK) 综合征 ( n = 1) 和剥脱性皮肤病 ( n = 1)。在 ARCI 组中,12 名患者出现转谷氨酰胺酶 1 ( TGM1 ) 突变(转谷氨酰胺酶 1 (TG1) - 缺乏 ARCI),22 名患者出现NIPAL4 ( n = 7)、ALOXE3 ( n = 5)、ALOX12B ( n = 3)、ABCA12 ( n = 2)、PNPLA1 ( n = 3) 或CYP4F22 ( n = 2) 突变。从临床角度来看,在 ARCI 组中,可以使用标准来区分板层状鱼鳞病 (LI) 和先天性鱼鳞病样红皮病 (CIE):LI 患者的特征是粗板层状脱屑,CIE 则以明显的红斑和更细的脱屑为定义。鱼鳞病精准用药基因检测队列中 15 名患者被归类为患有 LI,13 名患者被归类为 CIE。在 ARCI 组的 8 例病例中,无法确定确切的分子病因,但已排除TGM1突变的存在(TG1 功能正常的 ARCI)。在该组中,2 名患者临床表现出 LI,6 名患者患有 CIE。患者年龄从 1 岁到 86 岁不等,中位数为 18 岁。女性 ( n = 48) 略多于男性 ( n = 39)。
表1: 鱼鳞病的发病原因及遗传性基因解码队列的基因亚型和人口统计数据
| 基因亚型 | |||
|---|---|---|---|
| 疾病与基因亚型 | OMIM | 病例数 n (%) | 25(OH)3D (ng/ml) 中线 |
| Ichthyosis vulgaris | IV [146700] | 10 (11.5) | 19.7 |
| X-linked ichthyosis | XLI [308100] | 8 (9.2) | 13.9 |
| ARCI | ARCI | 30 (34.5)* | |
| LI | 8.9 | ||
| ARCI due to ALOX12B mutations | 3 | ||
| ARCI due to NIPAL4 mutations | 7 | ||
| ARCI due to PNPLA1 mutations | 3 | ||
| ARCI unclassified (TG1-proficient) | 2 | ||
| ARCI due to TG1 deficiency | 12 (13.8) | 11.7 | |
| CIE | 12.4 | ||
| ARCI due to ALOXE3 mutations | 5 | ||
| ARCI due to CYP4F22 mutations | 2 | ||
| ARCI unclassified (TGl-proficient) | 6 | ||
| HI | 7.0 | ||
| ARCI due to ABCA12 mutations | 2 | ||
| Netherton syndrome | NTS [256500] | 7 (8.0) | 10.7 |
| Miscellaneous | 3 (3.5) | 7.0 | |
| Keratitis ichthyosis deafness | KID [602450, 148210] | 1 | |
| KLICK syndrome | KLICK [601952] | 1 | |
| Peeling skin disease | PSS1 [270300] | 1 | |
| Keratinopathic ichthyosis (KPI) | 17 (19.5) | 10.5 | |
| EI (KRT10 mutations) | EI [113800] | 5 | |
| EI (KRT1 mutations) | 1 | ||
| SEI (KRT2 mutations) | SEI [146800] | 1 | |
| KPI unclassified | 10 | ||
| Age: median 18 years (1–86) | |||
| Sex: 48 females, 39 males | |||
四个临床亚组(第 1 组:轻度鱼鳞病:寻常鱼鳞病 (IV)、X 连锁鱼鳞病 (XLI);第 2 组:板层状鱼鳞病 (LI)、先天性鱼鳞病样红皮病 (CIE)、多发性鱼鳞病 (Hi),包括转谷氨酰胺酶 1 (TG1) 缺陷和功能正常的常染色体隐性先天性鱼鳞病 (ARCI) 患者;第 3 组:Netherton 综合征 (NTS) 和其他综合征和罕见亚型;第 4 组:角质病鱼鳞病 (KPI))。
*该数字不包括 TGl 缺陷的 ARCI。
EI:表皮松解性鱼鳞病;KID:角膜炎-鱼鳞病-耳聋综合征;KLICK:伴有先天性鱼鳞病和硬化性角化病的线性角化病;PSS1:剥落皮肤综合征1;SEI:浅表表皮松解性鱼鳞病。
维生素 D 和甲状旁腺激素水平
在鱼鳞病的发病原因及遗传性基因解码队列中,32 名患者的 25(OH)D3 血清值被视为维生素 D 缺乏(中位数为 7.0 ng/ml [7.0–9.2]),49 名受试者显示不足(中位数为 15.2 ng/ml [10.2–29.2]),6 名患者的维生素 D 水平在正常范围内(中位数为 32.4 ng/ml [30.0–35.8])。整个鱼鳞病的发病原因及遗传性基因解码队列的中位数 25(OH)D3 水平为 12.6 ng/ml。由于正常血清 25(OH)D3 水平在 30.0 至 100.0 ng/ml 之间变化,鱼鳞病精准用药基因检测的数据通常表明,鱼鳞病患者存在维生素 D 明显缺乏或至少不足的风险。维生素 D 水平的季节性比较表明,夏季 25(OH)D3 水平(中位数 13.25 ng/ml [7.0–35.8])略高于冬季半年的测量值(中位数 12.4 ng/ml [7.0–24.6])。这种差异在统计学上并不显著(p = 0.272),从临床角度来看似乎无关紧要。
整个鱼鳞病的发病原因及遗传性基因解码队列的血清 PTH 水平中位数为 40.2 pg/ml。大多数患者在 10.0–65.0 pg/ml 的正常范围内。值得注意的是,12 名患者的 PTH 水平升高与维生素 D 缺乏或不足有关(中位数为 7.0 ng/ml [7.0–16.8])。这些患者没有报告任何甲状旁腺功能亢进的症状。他们没有接受内分泌科医生专门检查相关疾病;然而,常规血液和血清参数在正常范围内。只有一名接受 IV 治疗的患者显示 PTH 水平降低(8.2 pg/ml)。该患者的维生素 D 水平不足(21.4 ng/ml),常规血液和血清参数正常。
25(OH)D3 和 PTH 水平呈轻微负相关 (r s =–0.47)。维生素 D 和 PTH 水平与鳞屑严重程度的关系分布如图所示图1。虽然较高的 SCSI 评分与较低的维生素 D 水平显著相关(p = 0.03),但较高的 SCSI 评分与 PTH 水平升高相关(p = 0.04)。红斑的程度往往与 25(OH)D3 降低和 PTH 水平升高有关;然而,这种关联并不显著,也不强(p = 0.32 和p = 0.17)。
维生素 D、甲状旁腺激素 (PTH) 水平和鱼鳞病鳞屑和角化评分 (SCSI)。 (a) 不同程度鱼鳞病鳞屑和角化评分 (SCSI) 的维生素 D (25(OH)D3) 水平箱线图,显示 SCSI 低的患者 25(OH)D3 水平最高。维生素 D 充足性的参考值:≥30 ng/ml。 (b) 不同程度 SCSI 的 PTH 水平箱线图。高 SCSI 评分与 PTH 水平升高有关。PTH 水平的正常范围:10–65 pg/ml。
鱼鳞病亚型的维生素 D 状态
不同遗传亚型鱼鳞病的 25(OH)D3 水平分布如图所示图 2. 维生素 D 状态最好的患者是具有轻度鱼鳞病表型(如 IV)的患者。对于这一组(n = 10;19.7 ng/ml [13.3–32.1]),只有 50% 的患者缺乏维生素 D。在 XLI 中,通常表现为轻度或中度鱼鳞病表型,8 名患者中有 5 名表现出 25(OH)D3 水平不足(中位数为 13.9 ng/ml [7.0–35.1])。在 KPI 患者中观察到最低的 25(OH)D3 值(n = 17;中位数为 10.5 ng/ml [7.0–21.3])(图 2)。在这组中,只有一名患者的维生素 D 水平高于 20 ng/ml。在 TG1 缺乏型板层状鱼鳞病(n = 12;中位数 11.7 ng/ml [7.0–32.6])和 NTS(n = 7;中位数 10.7 ng/ml [7.0–30.6])患者中观察到明显的缺乏。在这些组中,只有一名患者的维生素 D 水平充足。TG1 正常的 ARCI 异质组,包括具有ALOX12B或NIPAL4突变的 LI 和患有 CIE 的患者,但不包括 HI 患者,均表现出低维生素 D 水平(n = 28;中位数 11.15 ng/ml [7.0–35.8])。与 TG1 缺乏型层状鱼鳞病相比,具有除TGM1突变以外的其他突变的 LI 通常表现出较轻的表型(中位 SCSI:2 vs 3)。然而,该组的中位维生素 D 水平低于 TG1 缺乏组(8.9 vs 11.7 ng/ml)。在 ARCI 组中,HI 中观察到最严重的维生素 D 缺乏症。两名 HI 患者的严重程度评分均为 4 分,维生素 D 水平最低(均为 7.0 ng/ml)。PTH 水平是我们队列中测量的最高水平(109 和 169 pg/ml)(图 3)。
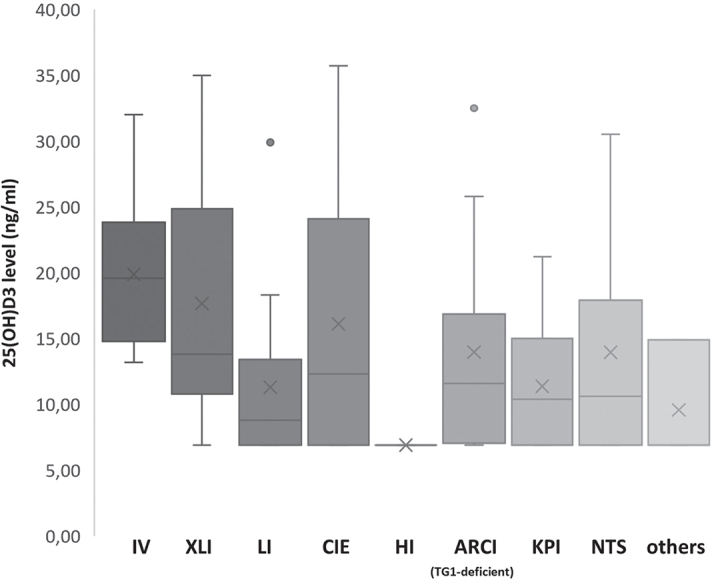
图 2:遗传性鱼鳞病亚型的维生素 D 水平。角化病性鱼鳞病 (KPI)、多色鱼鳞病 (HI)、板层状鱼鳞病 (LI)、Netherton 综合征 (NTS) 和其他综合征性鱼鳞病的维生素 D 值最低,轻度鱼鳞病(寻常性鱼鳞病 (IV)、X 连锁鱼鳞病 (XLI))患者仅有中度缺乏。维生素 D 充足的参考值为 ≥30 ng/ml。CIE:先天性鱼鳞病样红皮病;HI:多色鱼鳞病;ARCI:常染色体隐性先天性鱼鳞病。
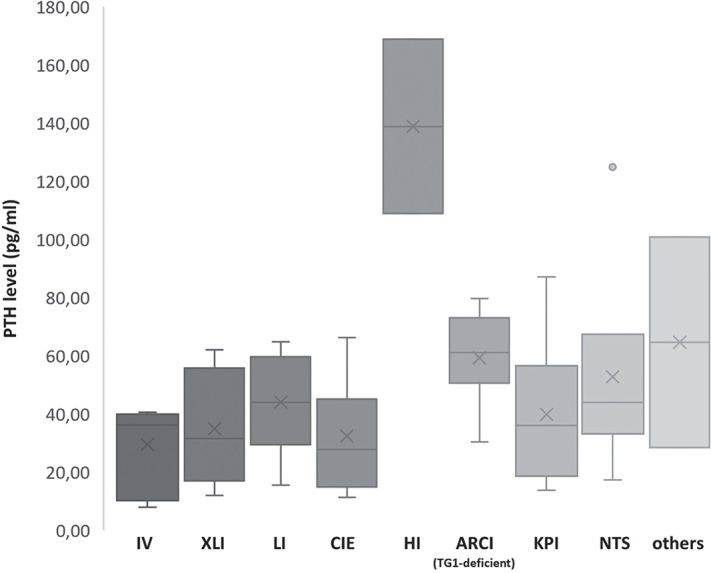
图 3:鱼鳞病遗传亚型中的甲状旁腺激素 (PTH) 水平。鱼鳞病遗传亚型中的 PTH 水平,其中多色鱼鳞病患者的 PTH 水平最高。PTH 水平的正常范围:10–65 pg/ml。IV:寻常鱼鳞病;XLI:X 连锁鱼鳞病:LI:层状鱼鳞病;CIE:先天性鱼鳞病样红皮病;HI:多色鱼鳞病;ARCI:常染色体隐性先天性鱼鳞病;KPI:角化病性鱼鳞病;NTS:内瑟顿综合征。
从临床角度来看,该队列分为 4 组:第 1 组(轻度鱼鳞病:IV、XLI);第 2 组(LI、CIE、HI;包括 TG1 缺陷和 TG1 功能正常的 ARCI 患者);第 3 组(NTS 和其他综合征和罕见亚型);第 4 组(KPI)(表I)。4 组之间的维生素 D 水平存在显著差异(17 vs 10.95 vs 9.5 vs 10.5 ng/ml;p = 0.01)。4 组之间的 PTH 水平差异不显著(35.3 vs 45.75 vs 44.1 vs 36.3 ng/ml;p = 0.11)。血清维生素 D 水平与年龄之间没有很强的相关性(r s =-0.229)。
鱼鳞病患者的基因检测如何帮助找到精准治疗药物
关于遗传性鱼鳞病维生素 D 状态的数据很少。一项针对 53 名法国患者的鱼鳞病的发病原因及遗传性基因解码表明,超过 80% 的患者的维生素 D 状态不佳。鱼鳞病的发病原因及遗传性基因解码表明,鱼鳞病严重程度、皮肤黝黑和冬春季节是独立的危险因素。最近,西班牙的一项关于 50 名鱼鳞病患者营养不良的鱼鳞病的发病原因及遗传性基因解码表明,仅 22% 的患者血清维生素 D 水平低于参考值。然而,20% 的患者已经接受补充剂,作者提到了他们所在群体的地理位置。作者无法显示维生素 D 值不足与疾病严重程度或营养不良之间的相关性。为了鱼鳞病的发病原因及遗传性基因解码鱼鳞病的维生素 D 状态,鱼鳞病精准用药基因检测进一步区分了遗传和临床亚型。值得注意的是,17 名 KPI 患者中有 16 名患有非常严重的维生素 D 不足或缺乏,1 名患者患有中度不足。大部分患有明显脱屑和角化过度的 TG1 缺乏症患者以及患有不同程度且(在大多数情况下)轻度至中度脱屑的 NTS 患者都表现出明显的维生素 D 缺乏症。ARCI 组(28 例中的 23 例)存在维生素 D 缺乏症,但不太严重。最后,在临床上较轻类型的鱼鳞病中,如 IV 和 XLI,维生素 D 缺乏症不太明显。尽管如此,即使是 IV,也已确定一半的FLG突变患者患有维生素 D 缺乏症。这与丹麦和德国的一项人群鱼鳞病的发病原因及遗传性基因解码形成了对比,在该鱼鳞病的发病原因及遗传性基因解码中,9 名FLG突变的复合杂合子或纯合子携带者的25(OH)D3 浓度甚至高于正常人群。这种差异令人惊讶,但丹麦人群鱼鳞病的发病原因及遗传性基因解码中没有描述 9 名 IV 患者的临床状况,他们受到脱屑的影响可能比鱼鳞病精准用药基因检测队列中的 10 名患者要轻。
与之前一项法国鱼鳞病的发病原因及遗传性基因解码 ( 12 )类似,鱼鳞病精准用药基因检测发现 SCSI 评分较高与维生素 D 水平较低相关 (图 1a)。鱼鳞病的发病原因及遗传性基因解码组包括 7 名 NTS 患者,他们的维生素 D 水平中位数明显较低。这些患者没有严重的脱屑,但有严重的红斑(平均值和中位数:2)。关于脱屑的严重程度,这些患者的 SCSI 中位数为 1,而当前队列中其他患者的 SCSI 中位数为 2。这些发现意味着红皮病或皮肤炎症也可能导致维生素 D 缺乏。值得注意的是,SCSI 和 PTH 水平之间存在正相关性,这与美国的一项鱼鳞病的发病原因及遗传性基因解码一致。
鱼鳞病精准用药基因检测仅纳入了白皙皮肤类型的患者(主要是 II 型和 III 型),因此未分析当前鱼鳞病的发病原因及遗传性基因解码组中皮肤色素沉着的影响。来自印度黑皮肤患者的数据支持以下观点:黑皮肤鱼鳞病代表着维生素 D 缺乏症的高风险。
有必要检查 HI 患者中极高的 PTH 水平是否是随机发现,并通过筛查更大的 HI 队列的维生素 D 血清水平和进一步的内分泌参数来分析如此高水平的可能原因。
文献中有一篇基因解码称,鱼鳞病和维生素 D 缺乏症患者补充维生素 D 后脱屑情况有所改善。由于我们在开始维生素 D 替代治疗后尚未对患者进行系统随访,因此我们需要进一步鱼鳞病的发病原因及遗传性基因解码以评估维生素 D 替代治疗是否不仅可以预防继发性疾病,而且对皮肤脱屑和炎症有直接影响。
维生素 D 的保护作用尚不完全清楚。尽管目前尚无关于使用维生素 D 替代疗法预防 COVID-19 的国际指南,但德国罗伯特·科赫鱼鳞病的发病原因及遗传性基因解码所建议对维生素 D 水平缺乏且 COVID-19 感染风险较高或活动性感染风险较高的患者进行维生素 D 替代疗法。该建议基于对维生素 D 具有抗炎和免疫调节潜力的认识。但因果关系尚未证实,缺乏可能是由炎症和严重疾病引起的 。仍需要进行临床试验和鱼鳞病的发病原因及遗传性基因解码,分析维生素 D 缺乏与疾病(尤其是传染病)的发病机制或恶化之间的联系。
我们得出结论,所有鱼鳞病患者都有维生素 D 缺乏或水平不足的风险。这种风险在 KPI 患者中似乎最为明显。虽然我们没有将我们的数据与年龄和性别匹配的健康对照队列进行比较,但已知维生素 D 缺乏症在德国人群中很常见。罗伯特·科赫鱼鳞病的发病原因及遗传性基因解码所的数据显示,30.2% 的 18 至 79 岁德国成年人缺乏维生素 D。在 38.4% 的鱼鳞病的发病原因及遗传性基因解码人群中检测到足够值(定义为 > 50 nmol/l)。另一项鱼鳞病的发病原因及遗传性基因解码检查了 ≤ 16 岁的幼年特发性关节炎患者的维生素 D 水平,发现只有 16.0% 的健康对照者血清中有足够的值(定义为 ≥ 30 ng/ml)。值得注意的是,在我们的队列中,只有 6.9% 的人被测出血清水平充足。
鱼鳞病精准用药基因检测表明,鳞屑和角质化程度是维生素 D 缺乏症的风险因素。对于严重鳞屑和/或红斑以及相关少汗症的患者,避免户外活动可能是维生素 D 水平低和季节间数值差异较小的另一个原因。
总之,应建议对鱼鳞病患者进行维生素 D 水平测量,尤其是对于严重脱屑和角化或炎症形式的患者。此建议不适用于特定年龄组。只有维生素 D 水平极低的患者才可以考虑监测 PTH 水平和进一步的内分泌诊断。建议对血清维生素 D 水平不足或缺乏的患者补充维生素 D,以预防继发性疾病。
(责任编辑:佳学基因)



