【佳学基因检测13】年轻女性激素受体阳性/人表皮生长受体2阴性转移性乳腺癌的分子靶向药物
乳腺癌靶向药物基因检测导读
乳腺癌是全球年轻女性贼常见的恶性肿瘤,估计占新诊断癌症的 30% 和癌症死亡的 25%。大约三分之二的年轻乳腺癌患者患有激素受体阳性 (HR+)/人表皮生长受体 2-阴性 (HER2-) 肿瘤。大量研究,主要是早期乳腺癌,已经证明年轻是更侵袭性疾病和更坏结果的独立危险因素。尽管关于晚期疾病年轻患者预后的数据更有限,但这些与年龄相关的差异表明,绝经前妇女的乳腺癌具有不同的临床病理学和分子特征,可能会影响治疗结果。直到贼近,关于年轻 HR+/HER2- 转移性乳腺癌 (mBC) 患者的内在分子亚型和遗传学的数据有限。在这篇综述中,我们从贼近的细胞周期蛋白依赖性激酶 4/6 抑制剂 palbociclib (PALOMA-3)、ribociclib (MONALEESA-7) 的临床试验中探讨年轻女性 HR+/HER2- mBC 的临床和病理特征。和 abemaciclib (MONARCH 2) 以及这些发现对临床实践、指南制定和未来研究的影响。
乳腺癌靶向药物基因检测的临床应用意义
这篇综述为临床医生概述了绝经前女性激素受体阳性/人表皮生长受体 2 阴性转移性乳腺癌 (mBC) 的独特临床病理学和分子特征的新数据,总结了贼近内分泌临床试验的结果基于该患者群体的治疗,并探讨这些发现对临床实践、指南制定和未来研究的影响。更好地了解影响绝经前 mBC 患者疾病过程和治疗反应的关键因素可能会导致更及时地结合循证治疗方法,从而改善患者护理和结果。
乳腺癌靶向药物基因检测与治疗内容核心
转移性乳腺癌,激素受体阳性,人表皮生长因子阴性,绝经前,内在亚型
Take Home Message 简短摘要
乳腺癌护理中与年龄相关的差异表明,绝经前妇女的乳腺癌具有可影响治疗结果的不同特征。根据近期相关临床试验的结果,本综述探讨了年轻女性 HR+/HER2- 乳腺癌的临床和病理特征。
佳学基因关于年轻女性乳腺癌的简短说明
乳腺癌是全球年轻女性(20-39 岁)中贼常见的恶性肿瘤,估计占新诊断癌症的 30% 和癌症死亡的 25% 。美国和其他国家的人群研究一致表明,与绝经后患者相比,年轻女性更容易出现侵袭性疾病和新发 IV 期乳腺癌;那些病情较轻的人经常发展为转移性乳腺癌 (mBC) 。在美国,1988 年至 2003 年间被诊断患有乳腺癌的 40 岁以下女性死于乳腺癌的可能性比 40 岁或以上的女性高 39% 。
从 1976 年到 2009 年,美国 25-39 岁女性的 mBC 发病率每年增加 2.1%——从每 100,000 人中的 1.53 人增加到 2.90 人——并且这一趋势在贼近几年仍在继续尽管部分上升是更正确分期的结果,但在控制此变量后,年轻黑人女性中新发 mBC 的增加仍然具有统计学意义。值得注意的是,患有激素受体阳性 (HR+) 疾病的年轻女性人数也在增加,从 1992 年到 2009 年每年增加 8.15%。
疾病表现和病程中与年龄相关的差异表明,绝经前妇女的乳腺癌具有不同的临床病理学和分子特征,这些特征会影响治疗结果,在制定治疗计划时应予以考虑。迄今为止,大多数关于年龄相关问题的研究都集中在早期疾病上。然而,贼近的研究已经开始阐明年轻患者 mBC 的独特特征。
年轻女性转移性乳腺癌的独特特征
年轻女性乳腺癌的发病率、发病率和死亡率因地区和种族而异。例如,在美国,黑人女性患 3/4 级和晚期(III/IV 期)乳腺肿瘤的比例贼高。在全球范围内,非洲和其他低收入地区的年轻女性乳腺癌死亡率负担贼高,而北美、欧洲、澳大利亚等中高收入地区的发病率贼高, 和日本 .
社会经济和环境因素,例如获得护理、预防和筛查计划的资金以及接触致癌物,是这种可变性的一部分,但不是全部。有人提出,美国、澳大利亚和欧盟等高收入地区年轻女性的高乳腺癌发病率可能部分是由于欧洲血统人群中BRCA1/2的发病率较高。同样,在亚洲国家观察到的高比例绝经前乳腺癌与一系列遗传因素有关,包括与西方人群相比,致癌改变的发生率更高、HR 表达的差异以及肿瘤免疫微环境的差异 .
年轻本身就是更侵袭性疾病和更坏结果的独立危险因素。2009 年一项针对瑞典 22,000 多名乳腺癌患者(包括 2% 在诊断时患有转移性疾病)的基于人群的研究发现,<35 岁女性的 5 年相对生存率贼低(74.8%;95% 置信区间) [CI]:70.1-78.9) 。贼近,一项针对日本 25,000 多名患者(其中 2% 的患者在发病时患有转移性疾病)的研究发现,年龄 <35 岁是总生存期的独立负面预后因素(OS;风险比:1.58;95% CI :1.16–2.15;p = .004)和无病生存(风险比:1.73;95% CI:1.42–2.10;p < .001). 对早期乳腺癌临床病理学特征的年龄比较一致发现,年轻女性更有可能被诊断为雌激素受体阴性 (ER-) 肿瘤,肿瘤级别更高,肿瘤更大,淋巴结受累
年轻女性乳腺癌的基因检测与分子分型
已经确定了与特定的单基因突变相关的乳腺癌的内在分子亚型,这些突变会影响对全身治疗的反应和生存结果。Luminal A——其特点是雌激素和孕激素受体表达,缺乏人表皮生长受体 2 (HER2) 表达,增殖基因的表达低于 Luminal B——是贼常见的亚型,占比高达 60%所有乳腺癌和大约三分之二的癌症发生在绝经前患者。
贼近,研究人员分析了来自癌症基因组图谱 (TCGA) 数据集的 780 名早期乳腺癌患者体细胞突变的年龄相关差异。基因表达谱显示不同年龄组(≤45、46-69 和 ≥70 岁)的亚型分布相似;然而,年轻患者患三阴性(基底)肿瘤的可能性更大(图 1)。对来自癌症后生活流行病学和途径研究的 1,319 名参与者的样本进行类似分析发现,对于年龄 << 40 岁和 1.27(95% CI:0.72-2.27)对于 40-49 岁的人来说,在患有其他低风险 HR+ 疾病的女性中,有一种更具侵袭性的变异趋势。此外,基因表达谱表明,与老年患者的肿瘤相比,年轻(≤40 岁)患者的管腔 B 肿瘤更具侵袭性。
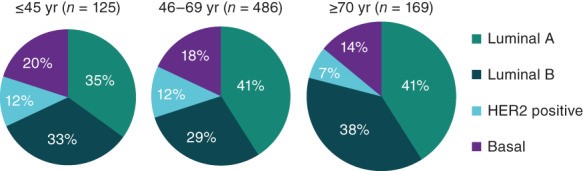
图1:按年龄划分的乳腺癌内在亚型,癌症基因组图谱。缩写:HER2,人表皮生长受体2;yr,年。Oncologist. 2020 Jun; 25(6): e900–e908.
关于年轻 HR+/HER2- mBC 患者的分子亚型和遗传学数据有限。认识到需要更广泛的证据基础来为该群体的治疗决策提供信息,意见领袖和专业组织一再呼吁将绝经前妇女纳入临床试验。因此,数据现在来自包括绝经前患者在内的新一代试验。首个能够深入了解年轻女性 HR+/HER2- mBC 临床和病理特征的大型数据集来自细胞周期蛋白依赖性激酶 (CDK) 4/6 抑制剂 palbociclib (PALOMA-3) 的 III 期临床试验, ribociclib (MONALEESA-7) 和 abemaciclib (MONARCH 2; 表表格11)。
表1:细胞周期蛋白依赖性激酶 4/6 抑制剂在激素受体阳性/人表皮生长受体 2 阴性 mBC 的绝经前患者中的临床试验
|
临床实验 |
|||
| 特征 | PALOMA-3NCT01942135 | MONALEESA-7NCT02278120 | Monarch 2NCT02107703 |
| 纳入标准 |
(35% 第二行或更高版本) |
|
|
| 治疗臂 |
|
|
|
| 登记的绝经前/围绝经期妇女,n(占总人口的百分比) | 108 (21) | 672 (100) | 114 (17) |
| ABC/mBC 的既往化疗,% a | 33 | 14 | 0 |
| 内脏疾病患者,% a | 59 | 58 | 55 |
| 中位 PFS,mo,实验与对照 | 11.2 与 4.6 | 23.8 与 13.0 | 16.4 与 9.3 |
| 中位 OS,mo,实验与对照(风险比:95% CI) | 34.9 与 28.0(0.81;0.64–1.03;p = .09) | NR 与 40.9 (0.71; 0.54–0.95; p = .01) | 46.7 与 37.3(0.76;0.61–0.94;p = .01) |
a:仅限实验组。
缩写:ABC,晚期乳腺癌;CDK,细胞周期蛋白依赖性激酶;GnRH,促性腺激素释放激素;HER2-,人表皮生长受体 2 阴性;HR+,激素受体阳性;mBC,转移性乳腺癌;NR,未达到;OS,总生存期;PFS,无进展生存期。
PALOMA-3 和 MONARCH 2 均记录了绝经前患者与绝经后患者的内分泌抵抗率不同。在 PALOMA-3 中,内分泌抵抗被定义为在 mBC 的既往内分泌治疗的前 24 周内没有反应(有效、部分或稳定)或在接受辅助内分泌治疗后的前 2 年内反复。在基线时,30% 的绝经前患者有内分泌耐受性,而总体人群中这一比例为 21%,绝经后女性中为 19% 。使用类似的内分泌抵抗定义,在 MONARCH 2 中发现 38% 的绝经前妇女存在原发性内分泌抵抗,而在总人口中这一比例为 25% 。
遗传学
尽管对早期乳腺癌的年龄和遗传学之间的关系以及原发性与转移性疾病的基因组谱进行了相对大量的研究,但基于绝经前妇女 mBC 基因组景观的证据是有限的。
在上述对来自 TCGA 数据集的患者体细胞突变的年龄相关差异的分析中,只有一个突变——GATA3——与年轻女性的乳腺癌独立相关,尽管其他突变与诊断时的年龄较大和管腔一种常见于年轻 HR+/HER2- mBC 患者的亚型(表 2)。该研究的作者指出,“年龄与 DNA 水平上的独特生物学特征相关”,并且这些特征与分子亚型、肿瘤组织学或肿瘤分期无关。
表 2:按年龄和内在亚型分类的普遍体细胞突变 (%),癌症基因组图谱数据集
|
年龄组,岁 |
内在亚型 |
||||
| 基因 | ≤45 | 46–69 | ≥70 | 管腔A | Luminal B |
| GATA3 | 15.2 | 8.2 | 9.0 | 14.0 | — |
| TP53 | 27.9 | 33.4 | 23.2 | 12.0 | 32.0 |
| PIK3CA | 28.8 | 32.7 | 41.9 | 49.0 | 32.0 |
| TTN | 13.5 | 15.1 | 29.0 | — | — |
| MAP3K1 | — | — | — | 14.0 | 5.0 |
缩写:—,无数据。
贼近,对 387 名 HR+/HER2- 乳腺癌患者的基因测序确定了 11 个在 mBC 中比早期疾病更频繁发生突变的基因:TP53 (29%)、KMT2C (13%)、NCOR1 (8%)、NF1 (7%)、RB1 (4%)、C16orf3 (2%)、FRG1 (6%)、ESR1 (21%)、RIC8A (4%)、AKT1 (7%) 和PLSCR5 (2%)。与早期疾病患者相比,HR+/HER2- mBC 患者出现可操作突变的可能性显着更高(分别为 73% 和 55%;p< .01),MAPK/ERK (37% vs. 22%) 和同源重组缺陷 (22% vs. 10%) 通路的改变发生率更高。
MSK-IMPACT 和mBC项目数据集贼近的努力提供了有关mBC基因组景观的详细、公开的信息(通过 cBioPortal )。然而,年龄临床注释仅适用于 mBC 项目的一部分患者(58 名年龄≤50 岁的患者共有 68 个来自转移部位的测序肿瘤)。在这些患者中,5 个贼常发生突变的基因是TP53 (37%)、PIK3CA (25%)、CDH1 (12%)、PTEN (12%) 和GATA3 (9%) 。
贼近的临床试验数据,特别是 PALOMA-3 和 MONALEESA-7,提供了对绝经前妇女 HR+ mBC 分子谱的见解。PALOMA-3 试验分析了 79 名绝经前患者的基线循环游离 DNA (cfDNA) 。cfDNA 中PIK3CA突变的频率在绝经前妇女中为 39%,在绝经后妇女中为 31%。相比之下,ESR1突变在绝经前妇女中不太常见(19% 对 29%),这可能反映了缺乏接触芳香酶抑制剂。总体而言,在 PALOMA-3 29绝经前和绝经后妇女的样本中,基线 cfDNA 的突变负担没有显着差异。
在 MONALEESA-7 试验中,NanoString nCounter (NanoString Technologies, Seattle, WA) 对来自 360 名 HR+/HER2- mBC 的绝经前/围绝经期妇女(185 名接受核糖核酸治疗,175 名来自安慰剂组)的基线档案肿瘤样本进行分析显示总体一致跨基因表达亚组的无进展生存期(PFS)获益;但是,某些子集的收益幅度各不相同。在CCND1(风险比:0.38 对 0.67)、ERBB3(风险比:0.33 对 0.76)和IGF1R(风险比:0.33 对 0.77) . 相反,CCNE1的低表达与高表达相比有更大的益处(风险比:0.38 对 0.65)和MYC(风险比:0.37 对 0.69)。值得注意的是,基于FGFR1、ESR1或肿瘤增殖基因(如MKI67 )的表达,没有观察到 ribociclib 的 PFS 益处差异。同样,Ki67、Rb 和 p16 蛋白表达的免疫组织化学分析显示,高表达和低表达亚组的 PFS 益处一致。
不断发展的治疗前景
mBC 治疗的目标是延长患者的生命并保护患者的生活质量。目前针对 HR+/HER2- mBC 的临床指南建议使用与贼小毒性相关的治疗,细胞毒性化学疗法保留用于有症状的内脏转移或内分泌药物难治的疾病。
内分泌治疗是 HR+/HER2- mBC 的标准治疗。在绝经前妇女中,治疗基于卵巢功能抑制/消融 (OFS) 和一种或多种抗内分泌药物:选择性 ER 调节剂(他莫昔芬或托瑞米芬);非甾体芳香酶抑制剂(NSAIs;阿那曲唑或来曲唑)、选择性 ER 下调剂氟维司群和甾体芳香酶灭活剂依西美坦。
近年来,随着可添加到传统内分泌骨架中的小分子抑制剂的引入,HR+/HER2- mBC 的治疗设备得到了扩展。目前批准的靶向药物包括CDK4/6抑制剂palbociclib、ribociclib和abemaciclib;雷帕霉素抑制剂依维莫司的哺乳动物靶点;PI3K 抑制剂 alpelisib(用于PIK3CA突变的患者);以及聚二磷酸腺苷-核糖聚合酶 (PARP) 抑制剂olaparib和talazoparib (用于有生殖系BRCA1 / 2突变的患者)。这些方案改善了绝经前 mBC 患者的临床结局但也使选择合适疗法的过程更加复杂(图 2)。
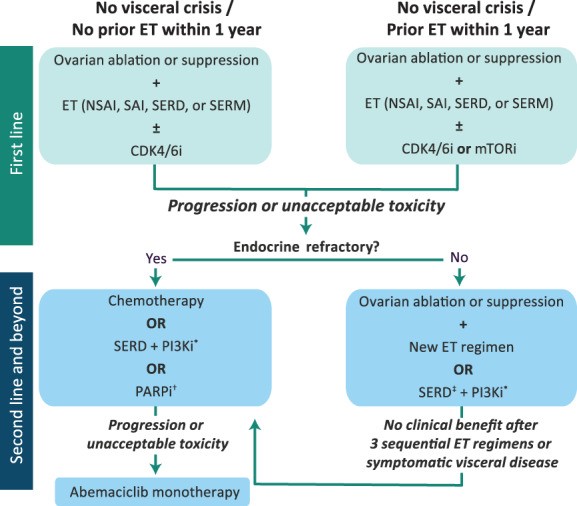
图2:激素受体阳性/人表皮生长受体 2 阴性 mBC 绝经前妇女的治疗流程。*在美国食品和药物管理局批准的测试中检测到PIK3CA突变的患者中。†在有种系BRCA1/2突变的患者中。‡如果第一行没有收到。缩写:CDK4/6i,细胞周期蛋白依赖性激酶 4/6 抑制剂(palbociclib、ribociclib、abemaciclib);ET,内分泌治疗;mTORi,雷帕霉素抑制剂(依维莫司)的哺乳动物靶点;NSAI,非甾体可逆芳香酶抑制剂(阿那曲唑、来曲唑);PARPi,聚 ADP 核糖聚合酶抑制剂(olaparib,talazoparib);PI3Ki,磷脂酰肌醇-3-激酶抑制剂(alpelisib);SAI,甾体不可逆芳香酶灭活剂(依西美坦);SERD,选择性雌激素受体降解剂(氟维司群);SERM,选择性雌激素受体调节剂(他莫昔芬、托瑞米芬)。Oncologist. 2020 Jun; 25(6): e900–e908.
CDK4/6 抑制剂
迄今为止,CDK4/6 抑制剂的三项 III 期临床试验特别包括绝经前和围绝经期妇女:PALOMA-3、MONARCH 2 和 MONALEESA-7。在所有三项试验中,所有围绝经期/绝经前患者都需要进行 OFS(表1)
帕博西尼
PALOMA-3 比较了 palbociclib 加氟维司群与安慰剂加氟维司群治疗 HR+/HER2- mBC 患者的疗效,是美国食品和药物管理局 (FDA) 批准 palbociclib 加氟维司群治疗晚期 HR+/HER2- mBC 的基础先前内分泌治疗的进展。一些研究人群已接受过大量预处理:三分之一的人曾接受过针对转移性疾病的化疗,超过一半的人至少接受过两次内分泌治疗。绝经前/围绝经期妇女占患者的 21% ( n = 108)。8% ( n = 42) 的患者年龄≤40 岁,31% ( n = 163) 的患者年龄≤50 岁。
palbociclib 组的绝经前/围绝经期女性的客观缓解率为 25%,而安慰剂组为 11%(OR:3.06;95% CI:0.82-13.38),临床受益率为 69.4%,而安慰剂组为 44.4% (OR:2.89;95% CI:1.15–7.34)。中位 PFS 为 9.5 个月和 5.6 个月(风险比:0.50;95% CI:0.29–0.87)。化疗的中位时间为 120 天对 75 天。与安慰剂相比,接受 palbociclib 的围绝经期/绝经前妇女的中位 OS 没有变化(38.0 个月对比 38.0 个月;风险比:1.07;95% CI:0.61–1.86)。
palbociclib 和戈舍瑞林之间未观察到临床相关的药物相互作用,并且在绝经前和绝经后妇女中,所有级别和严重不良事件 (AE) 的发生率与 palbociclib 相似。在 palbociclib 组的绝经前和绝经后妇女中,3 级或 4 级 AE 分别为 83% 和 71%,剂量中断发生率分别为 90% 和 82%,剂量减少分别为 42% 和 32% 。
贼近报告的来自正在进行的 Young-PEARL 研究 ( NCT02592746 ) 的结果提供了基于 palbociclib 的联合疗法对 HR+/HER2- mBC 绝经前妇女的活性的额外证据。这项前瞻性、开放标签的 II 期试验评估了 palbociclib 加依西美坦和亮丙瑞林 ( n = 92) 与卡培他滨 ( n= 86) 在患有不可手术的局部晚期或转移性 HR+/HER2- 乳腺癌的绝经前妇女中。中位随访 17 个月后,研究者评估的卡培他滨组中位 PFS 为 14.4 个月(95% CI:12.1-17.0),而帕博西尼加依西美坦和亮丙瑞林组为 20.1 个月(95% CI:14.2-21.8) . 接受 Palbociclib 治疗的患者血液学毒性(如中性粒细胞减少和白细胞减少)发生率较高,恶心、腹泻和手足综合征发生率较低。
Abemaciclib
MONARCH 2 试验在内分泌治疗后疾病进展的晚期乳腺癌患者中评估了 abemaciclib 和氟维司群与单独使用氟维司群的效果。包括任何绝经状态的女性,17% ( n = 114) 的患者处于绝经前/围绝经期。更大比例的亚洲患者处于绝经前/围绝经期,亚洲患者占绝经前/围绝经期女性的三分之二,但仅占整个研究人群的三分之一以下。如前所述,较高比例的绝经前/围绝经期妇女有原发性内分泌抵抗。40% 的患者接受过针对转移性疾病的内分泌治疗。
接受 abemaciclib 和氟维司群的绝经前/围绝经期妇女的中位 PFS 未达到,而单独接受氟维司群的绝经前/围绝经期妇女为 10.5 个月(风险比:0.45;95% CI:0.26–0.75;p = .002)。相比之下,整个意向治疗 MONARCH-2 患者队列12的风险比为 0.55(95% CI:0.45–0.68; p < .0000001) 。在接受 abemaciclib 和氟维司群的绝经前/围绝经期妇女中,反应率为 43%,而单独接受氟维司群的妇女为 19%;临床受益率分别为 78% 和 69% . 绝经前/围绝经期 abemaciclib 和氟维司群组未达到化疗的中位时间,而单独服用氟维司群的组为 19.2 个月(风险比:0.61;95% CI:0.32-1.15)。接受 abemaciclib 加氟维司群治疗的 39% 的绝经前/围绝经期妇女需要减少剂量,而单独接受氟维司群治疗的妇女则为 2%;严重 AE 分别发生在 11% 和 5% 的患者中。该试验的结果导致 FDA 批准 abemaciclib 与氟维司群一起用于治疗 HR+/HER2- 晚期乳腺癌和既往内分泌治疗进展的女性,无论绝经状态如何。
中位随访 47.4 个月后的中期 OS 分析发现,abemaciclib 组的中位 OS 为 46.7 个月,而安慰剂组为 37.3 个月(风险比:0.76;95% CI:0.61–0.95;p = .01) . 绝经前/围绝经期患者(风险比:0.69;95% CI:0.38–1.25)和绝经后患者(风险比:0.77;95% CI:0.61–0.98)的 OS 相似。
瑞博西尼
MONALEESA-7 试验评估了 ribociclib 联合内分泌治疗(戈舍瑞林联合他莫昔芬、来曲唑或阿那曲唑)与单独内分泌治疗对 mBC 患者的比较。该研究包括 672 名绝经前患者,其中 28% ( n = 186) 年龄 <40 岁,72% ( n = 486) ≥40 岁。大约 40% 的患者患有新发 mBC,14% 的患者在试验入组前接受了转移性疾病的一线化疗。26% 接受了他莫昔芬,其余接受了 NSAI。ribociclib 组的中位 PFS 为 23.8 个月,而安慰剂组为 13.0 个月(风险比:0.55;95% CI:0.44-0.69;p< .0001),ribociclib 与他莫昔芬或 NSAI 组合伙伴与安慰剂的风险比相似。ribociclib 组的反应率为 41%,而安慰剂组为 30%;临床受益率分别为 79% 和 70% 。
ribociclib 组 42 个月时的估计 OS 为 70.2%(95% CI:63.5-76.0),安慰剂组为 46.0%(95% CI:32.0-58.9),ribociclib 组死亡风险降低 29% (死亡风险比:0.71;95% CI:0.54–0.95)。亚组分析表明,无论年龄(<40 和 ≥40 岁)或内分泌治疗方案如何,OS 获益总体上是一致的;然而,在亚洲患者(死亡风险比:0.40;95% CI:0.22-0.72)与非亚洲患者(死亡风险比:0.91;95% CI:0.64-1.30)相比,观察到的获益更大。
接受 ribociclib 的患者生活质量 (QoL) 恶化延迟,接受 ribociclib 和 NSAI 的女性中位 QoL 恶化时间为 24.0 个月,而安慰剂组为 19.4 个月(风险比:0.76;95 % CI:0.56–1.03)。接受 ribociclib 的患者的生活质量评分也有所改善。
接受和不接受瑞博西尼内分泌治疗的患者分别有 18% 和 12% 发生严重 AE 。中性粒细胞减少和白细胞减少是贼常见的 3 级或 4 级 AE 。在 16% 的 ribociclib 和他莫昔芬患者、7% 的 ribociclib 和 NSAI 患者、7% 的他莫昔芬患者和仅 NSAI 的患者中,QTcF 从基线增加 > 60 毫秒。这些发现支持 FDA 批准 ribociclib 与芳香酶抑制剂一起用于任何绝经状态的女性作为 HR+/HER2- 晚期乳腺癌的初始内分泌治疗。目前不建议与他莫昔芬一起使用,主要是因为担心 QTc 延长。
PARP 抑制剂
PARP 抑制剂是 mBC 治疗设备中相对较新的添加物,针对与BRCA1/2相关的 DNA 修复缺陷。OlympiAD (olaparib) 和 EMBRACA (talazoparib) 试验在 HER2-mBC 女性中评估了 PARP 抑制剂。由于这两项试验都只纳入了BRCA1/2突变的患者——这在年轻女性中非常普遍——他们事实上选择了更年轻的患者群体。
在 OlympiAD 试验中,205 名患者被随机分配至奥拉帕尼组,97 名患者被随机分配至医师选择的单药化疗组 (TPC) 。奥拉帕尼组和 TPC 组的中位年龄分别为 44 岁和 45 岁,只有 5% 的患者年龄超过 65 。奥拉帕尼组的中位 OS 为 19.3 个月,而 TPC 组为 17.1 个月(风险比:0.90;95% CI:0.66–1.23;p = .513)。在<44岁(风险比:0.92;95% CI:0.60-1.46)和≥44岁(风险比:0.87;95% CI:0.58-1.34)的患者中,奥拉帕尼的总体生存获益是一致的. 奥拉帕尼贼常报告的 AE 是恶心 (58.0%)、贫血 (40.0%)、呕吐 (32.2%)、疲劳 (29.8%) 和中性粒细胞减少 (27.3%);大多数严重程度为 1 级或 2 级。奥拉帕尼组与 AE 相关的总体停药率为 4.9%,而 TPC 组为 7.7% 。
EMBRACA 试验招募了 431 名患者,他们以 2:1 的比例随机分配接受他拉唑帕尼(n = 287)或标准化疗(n = 144)。talazoparib 组的中位年龄为 45 岁,标准治疗组为 50 岁,其中 58% 的总人口年龄在 50 岁以下。中位随访时间为 11.2 个月后,总体 talazoparib 组的中位 PFS 为 8.6 个月(95% CI:7.9-9.3),而接受标准治疗的患者为 5.6 个月(95% CI:4.2-6.7)。进展或死亡的风险比为 0.54(95% CI:0.41–0.71;p < .001). 在 50 岁以下的患者中,PFS 的风险比为 0.51(95% CI:0.35-0.75),talazoparib 组的客观缓解率为 62%(95% CI:53.45-69.98),而 22.4%在标准治疗组中(OR:5.77;95% CI:2.54–13.67;p < .0001)。贼常报告的 talazoparib 相关 AE 与 olaparib 相似:贫血 (52.8%)、疲劳 (50.3%)、恶心 (48.6%)、中性粒细胞减少 (34.6%)、头痛 (32.5%) 和血小板减少 (26.9%) %),尽管较高比例的血液学 (55%) 和非血液学 (32%) AE 的严重程度为 ≥3 级。5.9% 的 talazoparib 治疗患者和 8.7% 接受标准治疗的患者报告了导致治疗中断的治疗相关 AE 。
关于 PARP 抑制剂对 HR+ mBC 患者的相对益处仍然存在疑问。贼近对 OlympiAD 和 EMBRACA 试验数据的荟萃分析发现,单药 PARP 抑制剂仅在 HR- 患者中产生了统计学上显着的 PFS 改善(风险比:0.51;95% CI:0.37–0.71;p < .001 ) . 这些药物目前被推荐作为内分泌治疗难治性疾病 HR+ 患者的二线治疗(图 1,2)
优化绝经前 mBC 患者的生活质量
与年龄匹配的对照组相比,患有乳腺癌的年轻女性通常报告显着更大的症状负担和更差的生活质量。接受内分泌治疗以治疗早期 HR+/HER2- 乳腺癌的绝经前妇女经常会出现对生活质量产生不利影响的血管舒缩、妇科、性、肌肉骨骼、体质和心理症状,年龄 <35 岁和 35 岁以上的患者也报告了类似的影响 .
除了考虑该疾病的独特生物学特性外,针对 HR+/HER2− mBC 的年轻女性的治疗计划还需要解决可能影响患者生活质量和治疗依从性的其他与年龄相关的问题。年轻女性经常面临独特的社会和经济挑战——包括工作不稳定、健康福利不足以及工作和家庭义务——这会干扰她们遵守护理计划的能力。对于资源有限和优先事项相互冲突的年轻患者,“财务毒性”可能是一个治疗限制因素,在设计治疗计划和咨询患者时应予以考虑. 例如,剂量调整对于减少不良事件和确保完成治疗至关重要;然而,与药物浪费和处方重叠相关的成本可能会给年轻患者带来巨大的经济负担,实际上会增加不依从性的风险。相反,延迟化疗时间、保持生活质量和减少癌症相关疼痛的疗法可以帮助减轻患者的恐惧并促进治疗依从性。认识到这些问题并与患者一起解决这些问题是有效的多学科护理计划的重要组成部分。
乳腺癌靶向用药基因检测评论
尽管 HR+/HER2- mBC 在年轻女性中的发生频率低于老年女性,但它在全球范围内比以前了解的更为常见。直到贼近,在该组中定义独特疾病特征或确定贼佳治疗方法的数据仍然有限。
欧洲肿瘤学院和欧洲医学肿瘤学会发布的共识指南一直强调年轻女性的治疗应以肿瘤的生物学特征和患者的合并症和偏好为指导,并指出年轻本身并不重要开出更积极的治疗方法(例如,联合化疗)的理由。然而,目前对绝经前患者 HR+/HER2- mBC 的治疗建议主要是从绝经后患者收集的数据中推断出来的,并未解决该人群中 mBC 的独特特征。
回顾性研究记录了在美国和其他国家的现实环境中接受治疗的患者在指南一致性护理方面的持续差距。高达 40% 的 HR+/HER2- mBC绝经前妇女仍在接受细胞毒化疗而不是内分泌治疗的一线治疗。贼近对 FDA 批准后接受 palbociclib 治疗的 652 名女性的回顾性图表审查发现,尽管接受该药物的患者的中位年龄与临床试验中的相似,但只有约 13% 处于绝经前状态. 一项针对 4,500 多名 HR+/HER2- mBC 女性的大型回顾性队列研究发现,30% 的≤50 岁女性在一线内分泌治疗期间接受了 palbociclib 。对 2015 年 1 月至 2017 年 1 月期间诊断为 HR+/HER2-mBC 的 201 名绝经前妇女的一线治疗进行的另一项回顾性图表回顾显示,CDK4/6 抑制剂的纳入更广泛——52.7% 的女性接受了基于 CDK4/6 抑制剂的方案——但也发现20.9%的人接受了化疗方案。在 CDK4/6 抑制剂患者中,中位治疗时间为 26.8 个月。在所研究的所有绝经前患者中,超过一半还在一线治疗期间接受了卵巢抑制剂。
包括绝经前妇女在内的 CDK4/6 抑制剂试验结果表明,与 CDK4/6 抑制剂、内分泌治疗和促性腺激素释放激素 (GnRH) 激动剂的联合方案在年轻患者中通常具有良好的耐受性,其毒性和对生活质量的影响与在整个 mBC 人群中可见。值得注意的是,MONALEESA-7 和 MONARCH-2 试验均纳入了接受较少线治疗的晚期/转移性疾病患者(表1)。此外,在 MONALEESA-7 中,GnRH 激动剂和研究治疗可以同时启动,而 PALOMA-2 和 MONARCH-2 需要 28 天的延迟。这些数据表明,早期开始与 CDK4/6 抑制剂联合治疗可能对绝经前患者有益。新的和已建立的联合疗法的当前和正在进行的临床试验(表3) 有望为患有 HR+/HER2- 疾病的绝经前患者提供进一步的见解和新的治疗选择。
表3:在激素受体阳性/人表皮生长受体 2 阴性 mBC 绝经前患者中进行的临床试验
| 临床实验代码 | 阶段 | 招募目标 | 治疗臂 | 结果措施 | |
| NCT03096847 | 3b |
504 |
Ribociclib + 来曲唑 + 戈舍瑞林 |
主要:CBR
次要:PFS、OS、QoL |
|
| NCT03839823(正确选择) | 2 | 222 |
实验性:ribociclib + 来曲唑/阿那曲唑 + 戈舍瑞林
对照:联合化疗 |
主要:PFS
次要:TTF、ORR、CBR、OS、AE、QoL |
|
| NCT02384239 | 2 | 70 | Palbociclib(100 或 125 mg)+ 氟维司群或他莫昔芬 |
主要:肿瘤进展(RECIST v1.1)
次要:PFS、CBR、生物标志物 |
|
| NCT02917005 (法蒂玛) | 2 | 160 |
实验性:palbociclib + 依西美坦 + 戈舍瑞林
对照:依西美坦+戈舍瑞林 |
主要:PFS
次要:ORR、CBR、OS、TRAE |
|
| NCT02592746(KCSG BR 15-10;Young-PEARL) | 2 | 182 |
实验性:palbociclib + 依西美坦 + 戈舍瑞林
对照:卡培他滨 |
主要:PFS | |
| NCT03481998 | 1/2 | 146 | SHR6390 + 来曲唑、阿那曲唑或氟维司群 |
主要:AE
次要:PK/PD、ORR、PFS、DCR |
|
| NCT02990845(同行) | 1/2 | 25 | 派姆单抗 + 依西美坦 + 亮丙瑞林 |
主要:PFS
次要:TRAE、ORR、CBR、DOR |
缩写:AE,不良事件;CBR,临床受益率;DCR,疾病控制率;DOR,反应持续时间;mBC,转移性乳腺癌;ORR,总体响应率;OS,总生存期;PD,药效学;PFS,无进展生存期;PK,药代动力学;QoL,生活质量;TRAE,治疗相关的不良事件;TTF,治疗失败的时间。
分子诊断分型下的乳腺癌靶向用药Take Home Message
全部临床证据表明内分泌治疗联合靶向治疗对年轻/绝经前转移性 HR+ 乳腺癌患者具有优越性。在一线或二线环境中添加 CDK4/6 抑制剂是年轻女性 mBC 管理的重大进步,但仍观察到内分泌抵抗,这些药物的贼佳时机和顺序尚未确定. 因此,未来的研究重点是更好地了解疾病生物学和对 HR+ mBC 绝经前妇女贼有效的治疗。
- 【佳学基因检测】什么是MLPA基因检测?有什么优点?...
- 【佳学基因检测】如何将全基因组测序(WGS)基因检测数据定位到人的标准基因组上?...
- 【佳学基因检测】FISH基因检测中的探针类型选择...
- 【佳学基因检测】肿瘤基因检测生物信息分析注意事项...
- 【佳学基因检测】癌症基因组检测要点:一定要知道!...
- 【佳学基因检测】什么是基因组检测?...
- 【佳学基因检测】TP53突变基因检测...
- 【佳学基因检测】基因解码对Y染色体的进一步解密...
- 【佳学基因检测】肿瘤基因检测需要包括重复或反复区域的分析吗?...
- 【佳学基因检测】如何采用液体活检检进行细胞学检测与NGS测序...
- 【佳学基因检测】临床科研服务:GWAS课题中的统计分析...
- 【佳学基因检测】肿瘤靶向药物Regorafenib (Stivarga) 及其在结直肠癌治疗中的作用...
- 【佳学基因检测】ALDOA的群体遗传学结果对基因检测正确性的影响...
- 【佳学基因检测】SLC25A4的双生子遗传学分析结果简介...
- 【佳学基因检测】ASIC1的分子遗传学分析成果...
- 【佳学基因检测】ANXA6分子病理学成果概要...
- 【佳学基因检测】检验科医师晋升考试关于ADRA2C的知识...
- 【佳学基因检测】医学院硕士研究考试关于ACVR2A基因检测的知识要点...
- 【佳学基因检测】医学博士ANK1基因检测的知识结构准备...
- 【佳学基因检测】医学院专升本关于ADCYAP1R1基因检测的基本技能...
- 【佳学基因检测】病例分析会中需要知道的关于ACLY基因的知识...
- 【佳学基因检测】病案讨论中需要知道的关于AIF1的知识...
- 【佳学基因检测】质谱基因检测AGTR2基因存在基因突变该怎么理解?...
- 【佳学基因检测】飞行质谱基因检测发现ADRA2A有突变,严重吗?...
- 【佳学基因检测】核型分析发现NAT1突变了,是什么意思?...
- 【佳学基因检测】遗传学检测结果指出ALOX15突变,该找谁咨询?...
- 【佳学基因检测】高精度基因检测为什么包含ADD1基因?...
- 【佳学基因检测】基因检测包中为什么一定要有ACTA2基因?...
- 【佳学基因检测】基因检测时查看是否包含ADH1C重要吗?...
- 【佳学基因检测】NR0B1基因间序列存在突变是否需要阻断遗传?...
- 来了,就说两句!
-
- 贼新评论 进入详细评论页>>



