【佳学基因检测】如何利用诱导多能干细胞(iPSC)进行遗传病的基因矫正治疗
佳学基因导读
为了让佳学基因及其他机构检出的遗传病患者系统性地了解基因矫正的国际进展,本文重点介绍了如何利诱导多能干细胞 (iPSC)及位点特异性核酸酶 (SSN) 介导的基因组编辑工具的结合所进行的基因矫正治疗研究。iPSC所能维持的多能性不仅为基础研究提供了充足、持续的细胞来源,也为人类疾病的精准医疗提供了载体。此外,快速发展的 SSN 基因矫正工具能够有效地定制基因操作以揭示、改变基因功能,从而为在不久的将来可用于纠正先天性疾病的遗传缺陷。iPSC 和 SSN 技术的结合还可以在体外重建完全模拟具有明确基因原因的、可不断重复的体外人类疾病模型,并为细胞替代和精准治疗提供新的解决方案。
关键词:诱导多能干细胞(iPSC)、位点特异性核酸酶(SSN)、锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、成簇的规律间隔短回文重复序列(CRISPR)/CRISPR相关系统9(Cas9)
诱导多能干细胞 (iPSC) 技术
2006年与2007年,Takahashi博士与Yamanaka博士通过强制表达四种与多能性相关的转录因子——Oct4、Klf4、Sox2与c-Myc,成功将小鼠及人类的体细胞重编程为多能状态。这些类似胚胎干细胞(ESC)的细胞被命名为诱导多能干细胞(iPSC)。iPSC具备与ESC相似的特征,包括自我更新能力、正常核型、可分化为三个胚层的细胞类型以及种系传递能力。由于兼具ESC样特性与个体化制备体细胞的潜力,该技术迅速引起全球范围内的广泛关注。
随着研究的深入,iPSC的诱导效率已得到显著提升,包括优化培养条件、筛选最佳细胞来源、改进载体设计,以及引入蛋白质和小分子辅助重编程策略。值得一提的是,侯博士的研究团队报道了无需引入Yamanaka因子,仅通过化学诱导即可成功建立iPSC的新方法。目前,iPSC已被广泛应用于基础研究领域,并成为发育生物学研究、疾病模型构建及药物筛选的重要体外平台(图1)。
图 1.
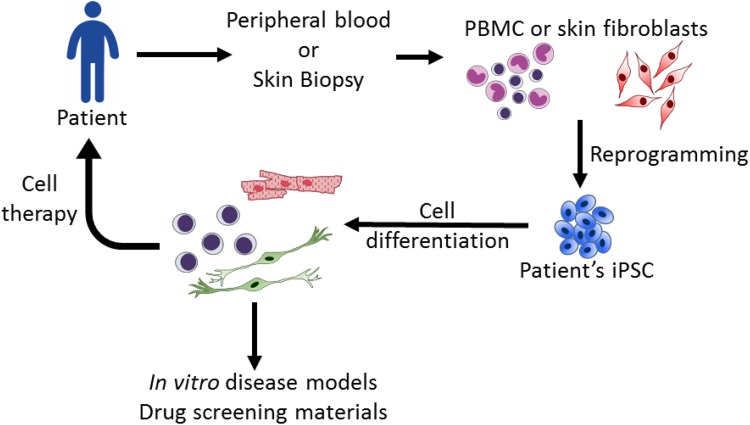
图1:诱导多能干细胞 (iPSC) 技术的应用。源自患者的 iPSC 可以分化成特定的细胞谱系,以重现细胞病变,用于疾病研究和潜在的药物筛选。在治疗方面,iPSC 衍生细胞可以提供移植材料。
通过多能干细胞(PSC)进行基因改变,不仅会从根本上提高研究人员在不同发育阶段或三维类器官结构中揭示细胞的功能及形态变化过程,控制和指导这些过程的基因表达模式、基因与与微环境调控动态作用,还为功能性修复特定细胞的功能提供了验证平台。佳学基因矫正团队在此重点介绍诱导性干细胞为载体的位点特异性基因矫正工具的 使用。
基因组编辑工具的开发:位点特异性核酸酶(SSN)应用前的基因组修饰
以iPSC为载体的基因矫正主要采用两种策略:随机插入与位点特异性靶向修饰。在随机插入方面,慢病毒和逆转录病毒是最常用的载体系统。另一种广泛应用的方法是采用具有随机插入特性的转座子工具,如Sleeping Beauty和piggyBac等。这些转座子系统通过转座酶蛋白的介导,能够将两端带有末端重复序列的DNA片段随机插入宿主基因组。与病毒载体相比,转座子工具的优势在于可通过再次表达转座酶将插入片段从基因组中切除,从而获得无转基因的细胞克隆。
外源DNA片段通过插入iPSC基因组可实现多种应用,包括构建基因特异性报告系统及实现基因过表达。尽管这类方法操作便捷,但也存在明显局限性。首先,随机插入可能引发宿主基因组突变;其次,插入基因的表达水平往往与内源基因的自然表达存在差异;此外,根据染色体整合位点的表观遗传特征,外源基因还可能遭遇基因沉默现象。
相比之下,位点特异性靶向插入策略能够提供更高的表达稳定性和基因操作精确性。目前大多数基因的转录调控机制尚未完全解析,这限制了传统转基因方法在基因功能研究中的应用。而位点特异性靶向技术能够有效克服这些缺陷,成为基因功能研究和基因治疗的重要工具。基于同源重组(HR)的定点整合是实现特异性插入的传统方法,该过程依赖于外源DNA两端同源臂与基因组靶位点的自发重组。
同源重组技术已在小鼠胚胎干细胞(mESC)中广泛应用,成功构建了多种基因敲入/敲除小鼠模型。在国际研究中,类似方法也被用于建立多种转基因人类多能干细胞(hPSC)疾病模型。这些策略还成功构建了诸如Oct4(多能性标记)和Oligo2(神经胶质细胞标记)等基因特异性报告系统,为细胞分化研究和特定谱系分离纯化提供了重要工具。
尽管同源重组技术在mESC中成效显著,但在hPSC中的应用却面临挑战。主要障碍在于hPSC对细胞分离操作极其敏感:大多数hPSC在分离过程中会因E-钙黏蛋白连接中断而引发细胞凋亡。这一特性不仅显著降低DNA转染或电穿孔效率,还严重影响获得单细胞来源靶向hPSC系的成功率。最新研究表明,通过添加Y27632(一种Rho/ROCK信号通路抑制剂)可有效维持细胞骨架结构,抑制分离诱导的细胞死亡。此外,当hPSC转化为幼稚状态时,这种细胞死亡现象也显著减弱。幼稚态hPSC表现出与mESC相似的特征,包括独特的细胞形态、生殖系标记表达以及单细胞状态下的高存活率,这些特性可能显著提升hPSC的基因组编辑效率。同时,新开发的无饲养层化学成分确定培养基不仅能避免饲养层细胞在基因转移过程中的干扰,还通过提高扩增细胞群体的均一性,从根本上加速了基因修饰hPSC的制备进程。
如何开发位点特异性基因矫正工具?
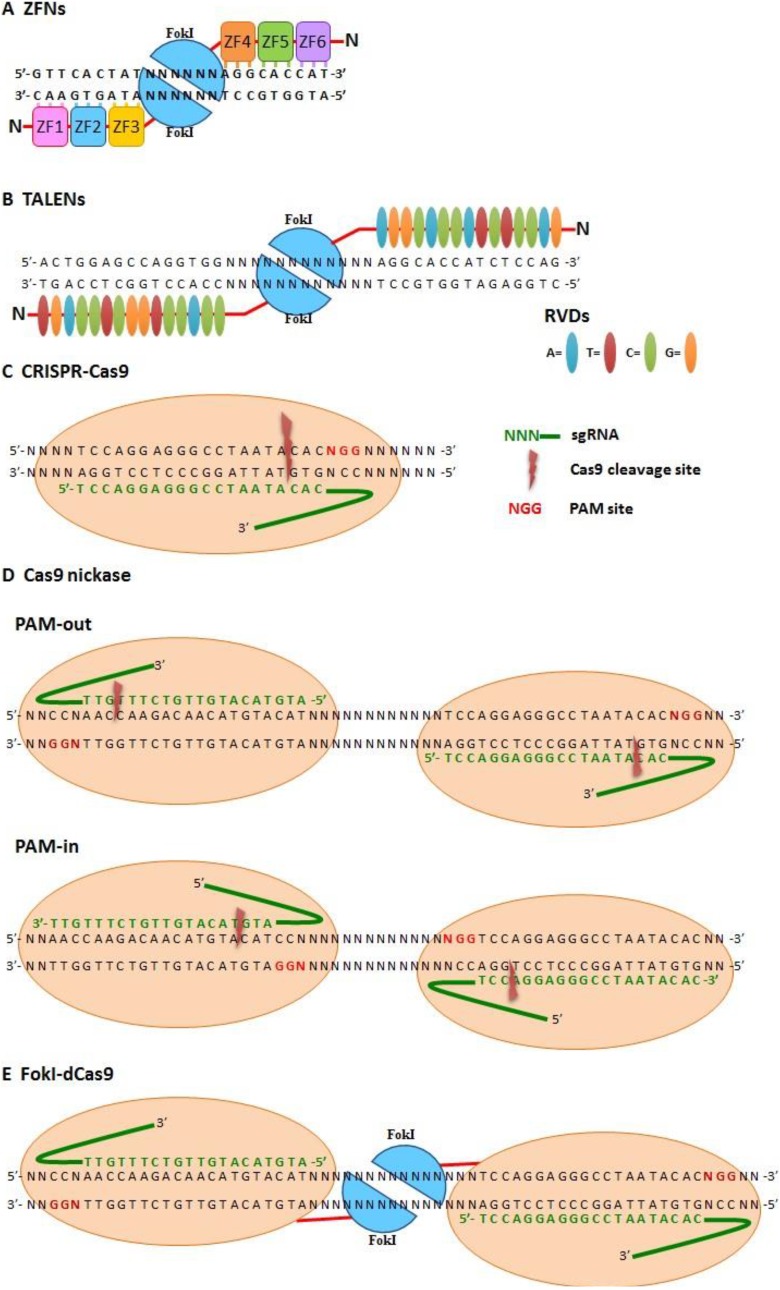
图2:基于位点特异性核酸酶(SSN)的基因组编辑工具。
(A) 锌指核酸酶(ZFNs):两种锌指核酸酶协同作用,通过每个锌指识别 3 个碱基的方式实现位点特异性识别,并利用二聚化的 FokI 核酸酶在 DNA 上产生双链断裂(DSB)。
(B) 转录激活因子样效应核酸酶(TALENs):两种 TALEN 协同作用,通过每个重复可变二残基(RVD)识别一个碱基的方式进行位点特异性识别,并通过二聚化的 FokI 在 DNA 上产生 DSB。
(C–E) 基于 Cas9 的 SSN 系统:单导 RNA(sgRNA)通过沃森-克里克碱基配对识别特定位点,并切割靶 DNA。
(C) 野生型 Cas9:在靶 DNA 上产生双链断裂;
(D) Cas9 单链核酸酶(Nickase):在 PAM 相对的“向外(PAM-out)”或“向内(PAM-in)”构型下造成双链单链切口;
(E) FokI-dCas9:利用二聚化的 FokI 结构域在靶 DNA 上造成 DSB。
通过在患有遗传性疾病个体的 DNA 上引入位点特异性的 DNA 断裂,位点特异性核酸酶(SSN)能够显著提高同源重组(HR)介导的基因矫正效率。SSN 可激活细胞的 DNA 修复机制,主要包括同源定向修复(HDR)和非同源末端连接(NHEJ)。目前应用最广泛的 SSN 类型包括锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)以及成簇规律间隔短回文重复序列/CRISPR 相关系统(CRISPR/Cas9)(图2)。
锌指核酸酶(ZFN)是在 2005 年发展起来的一种基因编辑工具,其核心是将识别特定 DNA 序列的锌指结构域与 DNA 核酸酶结合而成。ZFN 的 DNA 结合结构域由多个串联的锌指单元构成,每个锌指通常识别三个核苷酸。为在特异性和效率之间取得平衡,通常采用 3 至 6 个锌指单元作为最佳长度。ZFN 最常用的核酸酶域是 FokI 限制性内切酶(图2A)。目前,ZFN 已广泛用于人类基因组编辑领域,其中一项正在进行的临床试验是利用 ZFN 修饰趋化因子受体 CCR5,以期用于人类免疫缺陷病毒(HIV)的治疗。
尽管 ZFN 是一种强有力的基因组编辑工具,但其作为序列特异性核酸酶(SSN)仍存在一些局限性。首先,锌指结构域与目标核苷酸之间的最佳识别配对难以设计。构建能够与特定三核苷酸序列完全匹配的锌指蛋白需要复杂的蛋白工程。其次,DNA 序列的上下游背景以及锌指单元间的相互作用也会影响其结合效率。最后,较低的结合特异性可能引发脱靶效应,导致基因组的不准确修饰。
转录激活因子样效应核酸酶(TALEN)是另一种广泛应用于序列特异性基因编辑的核酸酶,由 DNA 结合结构域和核酸酶结构域组成。TALEN 的 DNA 结合区来源于植物病原细菌黄单胞菌(Xanthomonas),由一系列重复单元构成,每个单元含有 33~35 个氨基酸。重复序列中第 12 和第 13 位氨基酸组成重复可变二残基(RVD),在识别特定 DNA 碱基中起关键作用。例如,Asn-Gly(NG)识别胸腺嘧啶,His-Asp(HD)识别胞嘧啶,Asn-Ile(NI)识别腺嘌呤,Asn-Asn(NN)识别鸟嘌呤。通过合理设计的连续 RVD 序列,理论上 TALEN 可识别任意 DNA 目标序列。DNA 被识别结合后,其 FokI 核酸酶结构域介导 DNA 双链断裂(DSB),从而引发 HDR 或 NHEJ 修复反应(图2B)。
与ZFN相比,TALEN仅由四种类型的RVD(反向重复位点)覆盖四个核苷酸。这一优势使其更容易生成用于基因靶向的TALEN靶向克隆。为了克服组装连续重复残基的困难,人们开发了许多TALEN组装策略,包括金门法、白金门法和不依赖连接酶的克隆法(LIC)。
如何开发基于CRISPR/Cas9的基因矫正工具
CRISPR/Cas9系统是化脓性链球菌中最常见的SSN,最早是在针对噬菌体感染的微生物适应性免疫系统中发现的(表1)。CRISPR/Cas9介导的DNA识别和切割由三个组成部分组成:Cas核酸酶、CRISPR (cr)RNA和反式激活crRNA (tracrRNA) 。
表 1.锌指核酸酶 (ZFN)、转录激活因子样效应核酸酶 (TALEN) 和成簇的规律间隔短回文重复序列 (CRISPR)/CRISPR 相关系统 9 (Cas9) 的位点特异性核酸酶 (SSN) 基因组编辑工具的比较。
| SSN系统 | DNA识别类型 | 目标灵活性 | 易于设计和使用 | 瞄准效率 | 脱靶效应 |
|---|---|---|---|---|---|
| 锌指蛋白(ZFN) | 蛋白质向导,三聚体 | + | + | + | ++ |
| TALEN | 蛋白质导向,单体 | +++ | ++ | ++ | +++ |
| CRISRR/Cas9 | RNA 向导,单体 | +++ | +++ | +++ | + |
Cas9 包含两个核酸酶结构域 HNH 和 RuvC,用于形成 DSB 。对于 CRISPR/Cas 靶向,tracrRNA 促进 crRNA 成熟,并与加工后的 crRNA 结合形成小分子 (sg)RNA,用于靶向位点识别。基因靶向的特异性取决于靶向序列(也称为原型间隔区)与 sgRNA 和原型间隔邻近基序 (PAM) 的配对,后者与 Cas9 蛋白相互作用(图 2C)。
越来越多的证据表明,CRISPR/Cas9 的脱靶效应主要是由于 sgRNA 序列的高耐受性(最多 5 个错配)和 DSB 诱导的 NHEJ 修复所致。为了降低脱靶率并提高基因改造的准确性,通过失活 Cas9 的 RuvC 核酸酶区域(RuvC 的 D10A 突变体)产生 Cas9 切口酶,以触发 DNA 单链断裂并通过高保真碱基切除修复途径进行主要修复。具有反向 DNA 结合的配对 Cas9 切口酶能够制造双链切口(图2D )。与野生型 Cas9 相比,这种改良的 Cas9 切口酶方法可以将靶向特异性提高 50-1500 倍以上,同时也降低了脱靶率。截短的 sgRNA 也可能降低 CRISPR/Cas9 的脱靶效应。此外,用 FokI(称为 fCas9)替换 Cas9,与人类细胞中的野生型 Cas9 相比,靶向特异性提高了 140 倍以上(图2E)。
序列特异性核酸酶基因矫正在临床试验中的应用
对于基因治疗,高效基因组靶向工具的开发为临床应用提供了可能性。修正后的细胞可能有助于移植治疗。SSN 在临床试验中的首次应用是治疗获得性免疫缺陷综合症 (AIDS)。对于临床前艾滋病治疗,研究人员应用基因组编辑工具在 HIV 辅助受体 CCR5 中产生突变,从而阻断 HIV 感染和在 CD4 T 细胞上的增殖。修饰后的 T 细胞对 HIV 感染具有抵抗力。基于积极的结果,2009 年启动了一项 I 期研究,该研究使用 ZFN 修饰患者 CD4 T 细胞的 CCR5 进行自体移植。共招募了 12 名患有慢性无病毒血症 HIV 感染的患者,其中 6 名接受了 CCR5 编辑的 CD4 T 细胞自体移植治疗。结果显示,一名患者(该患者为 CCR5 delta 32 杂合子)的 HIV RNA 水平变得无法检测到,并且大多数患者的 HIV RNA 水平都有所下降。这项试验证明了该策略的安全性和疗效。值得注意的是,长期治疗需要补充CCR5编辑的T细胞,以克服编辑T细胞的短期存活问题,或者可以使用造血干细胞作为下一个基因工程靶点,以提供长期T细胞。
hPSC在临床试验中的应用
PSC 的临床试验已证明移植 PSC 衍生的分化细胞的安全性和有效性,包括治疗年龄相关性黄斑变性 (AMD)、I 型糖尿病、帕金森病 (PD) 和心肌梗死 (表 2 ) 。
表 2.当前基于人类多能干细胞 (hPSC) 的临床试验列表。
| 疾病 | 移植细胞类型 | PSC类型 | hPSC 来源 | 目前临床试验阶段 |
|---|---|---|---|---|
| 脊髓损伤 | 少突胶质细胞前体细胞 | ESC | 同种异体 | I |
| 干性年龄相关性黄斑变性和斯塔加特病 | 视网膜色素上皮 | ESC | 同种异体 | I/II |
| 湿性年龄相关性黄斑变性 | 视网膜色素上皮片 | 诱导多能干细胞 | 自体/同种异体 | I |
| 帕金森病 | 多巴胺能神经元 | 诱导多能干细胞 | 同种异体 | I |
| I型糖尿病 | β细胞祖细胞 | ESC | 同种异体 | I/II |
| 心肌梗死 | 心肌细胞 | ESC | 同种异体 | I |
ESC:胚胎干细胞;hPSC:人类多能干细胞;iPSC:诱导多能干细胞;PSC:多能干细胞。
首个使用人类胚胎干细胞(hESC)的临床试验针对脊髓损伤,由Geron公司支持。该I期临床试验于2010年10月启动。hESC衍生的少突胶质细胞祖细胞(GRNOPC1)被用于治疗亚急性期脊髓损伤患者。出乎意料的是,Geron公司于2013年停止了该项目。然而,由于在AMD治疗中成功使用hESC,Asterias公司于2016年重新启动了使用相同细胞类型的临床试验。
针对I型糖尿病 (DM),Viacyte公司于2014年10月启动了一项使用hESC衍生的胰腺前体细胞的I/II期临床试验。I型糖尿病是由β胰岛细胞的丢失引起的,患者需要终生注射胰岛素。在这项试验中,研究人员使用了一种生物相容性胶囊来保护hESC衍生的胰腺前体细胞免受免疫排斥。动物研究表明,这些被包裹的前体细胞能够感知血糖水平并长期分泌胰岛素,而不会形成畸胎瘤。然而,人体临床试验的详细结果仍在研究中。
人胚胎干细胞(hESC)衍生的心肌细胞具有治疗心肌梗死的潜力。在非人灵长类动物临床前研究中,移植ESC衍生的心肌细胞可改善心肌梗死后的心脏功能,且未出现室性心律失常相关问题。在I期临床试验中,hESC衍生的心脏祖细胞与纤维蛋白融合形成补片,然后将其移植到心脏受损区域。3个月后,心脏功能得到改善,未观察到心律失常。
PSC 衍生细胞的功能改善首先在 AMD 研究中得到验证。AMD 是老年人最常见的失明类型,由视网膜色素上皮 (RPE) 的进行性退化引起。Stargardt 黄斑营养不良 (SMD) 也是由 RPE 退化引起的,是一种由ABCA4、ELOVL4和PROM1突变引起的青少年发病的先天性疾病。AMD 和 SMD 患者的 I 期结果显示,植入 ESC 衍生的 RPE 片后未观察到肿瘤发生、免疫排斥和 RPE 增生。值得注意的是,对这些 I/II 期试验的长期观察表明,移植的 RPE 细胞与感光细胞层整合,并显著恢复了接受者的视力范围。
日本已开展使用 iPSC 治疗 AMD 的临床试验。I 期试验于 2014 年 9 月在日本启动,由京都大学 iPSC 研究与应用中心、日本理化学研究所发育生物学中心 (RIKEN CDB) 和神户市立医疗中心综合医院发起。这是世界上首个使用患者自身 iPSC 进行自体移植的临床试验。长期观察未发现肿瘤发生或免疫排斥。此外,移植衍生的 RPE 片可改善患者的视力下降。将招募更多临床患者来评估基于 iPSC 的细胞疗法的安全性。
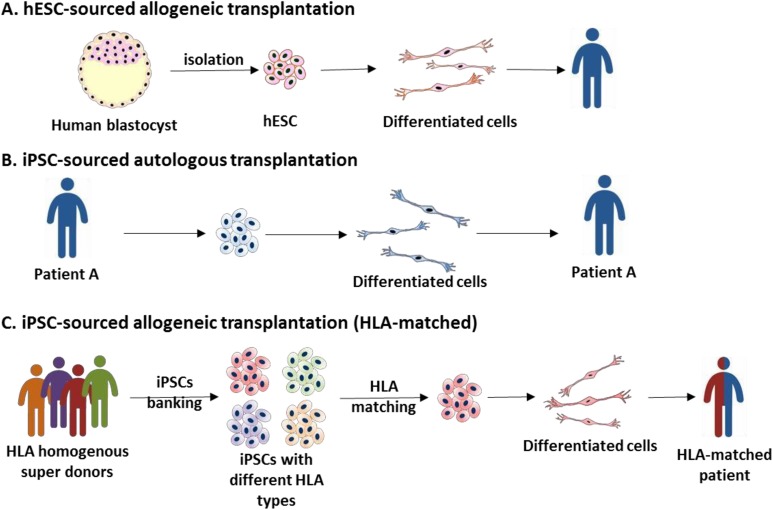
在上述临床试验中,大多数应用的 hESC 是同种异体的。同种异体移植仅可应用于一些免疫特权部位,例如眼睛和脊髓。需要考虑一些特殊策略以避免免疫排斥。个性化 iPSC 系可以解决免疫相关问题。然而,生成和鉴定个性化临床级 iPSC 系既昂贵又耗时。与人类白细胞抗原 (HLA) 匹配的供体进行同种异体移植是器官和骨髓移植的标准程序。建立和储存少量 HLA 纯合的超级供体 iPSC 系用于临床应用,而又没有严重免疫排斥的缺点,是一种理想的策略(图 3)。
基因组编辑工具拓展了基于iPSC的研究和疾病建模的应用范围
PSC 提供了一个体外模型,可以重现人类发育过程和细胞谱系分化,尤其是在早期胚胎阶段。通过基因组修饰,研究人员可以描绘不同发育阶段和 3D 类器官结构中的细胞命运、基因表达时序和生态位环境调控。分化中的 PSC 还可以作为一个平台,通过基因突变、缺失或替换在体外阐明单个或多个基因的功能及其生理作用(图4)。
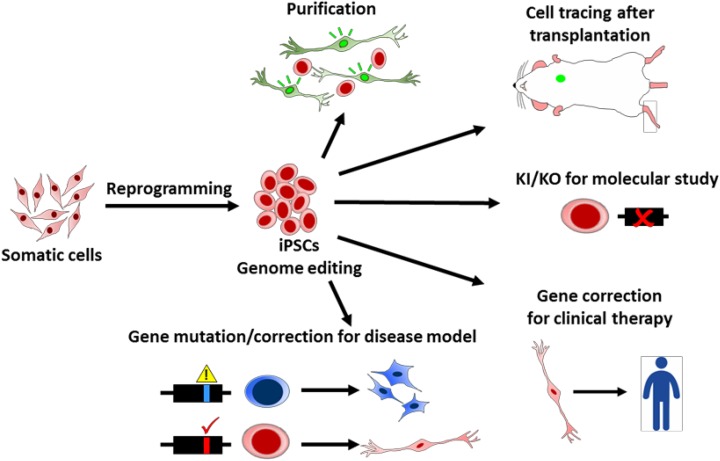
图4.基因组编辑工具在诱导多能干细胞 (iPSC) 技术中的应用。基因技术为 iPSC 研究提供了多种应用潜力。例如,基因组编辑工具可用于生成用于细胞纯化和示踪的报告细胞、用于分子研究的基因敲入和基因敲除 (KO)、用于疾病建模和临床治疗的基因突变或校正。
基因组编辑工具也为生成同基因型iPSC(用于精确疾病建模)提供了可行性。疾病型iPSC的特定突变可以通过基因组编辑工具人工制造或校正,从而生成同基因型疾病型iPSC,且在iPSC建立过程中不受细胞资源、随机突变和表观遗传变异的干扰。这种通过SSN介导的基因校正或导入进行的基因型/表型验证,巩固了候选基因位点在患者来源的iPSC中的作用。
SSN 介导的患者来源 PSC 的基因校正应用于帕金森病、尼曼匹克 C 型 (NPC) 病、镰状细胞病、β-地中海贫血、雷特综合征、囊性纤维化和 α1-抗胰蛋白酶缺乏症。CRISPR/Cas9 还用于校正毛细胞样细胞缺乏症中的 MYO15A 突变、骨髓增生异常综合征中的 7q 染色体缺失和隐性营养不良性大疱性表皮松解症 (RDEB) 中的 COL7A1突变。对于唐氏综合征 21 三体的校正,使用 ZFN 编辑工具将可诱导的 XIST 转基因引入 21 号染色体的 DYRK1A 基因座。这种修饰成功地沉默了21号染色体,并形成了21号染色体Barr小体,从而维持了基因表达的平衡。这两种技术的结合,还使我们能够生成针对杜氏肌营养不良症(DMD)等大规模染色体异常疾病的基因校正的iPSC 。以上例子表明,SSN介导的基因校正的hPSC不仅提供了研究材料,而且还有可能作为自体移植的健康细胞来源。
SSN/hPSC 组合应用的未来方向
将快速发展的基因组编辑工具与标准化的 hPSC 相结合,从根本上加速了人类发育研究、疾病建模、特定细胞示踪/分离和临床细胞治疗的科学进展。外源因子指导的PSC分化基本上遵循发育原则并反映早期胚胎形成,使 hPSC 成为研究人类早期发育的理想模型。鉴于 CRISPR/Cas9 介导的单基因敲除效率高,可以在 hPSC 及其衍生物中追踪破坏基因的影响。研究 PSC 球形 3D 类器官培养中的突变效应可以进一步拓宽细胞-细胞相互作用的影响范围,例如细胞迁移、特殊环境和组织建构。通过在 AAVS1 基因座稳定表达诱导型 Cas9,类似于小鼠的 ROSA26 基因座,也可以实现在所需发育阶段精确失活基因表达。这种 Cas9 内切酶 (iCRISPR) 的组成型表达显著提高了多基因失活的效率,并有助于在发育研究中同时探索直系同源基因。此外,CRISPR/Cas9 系统可以进一步改造为基因抑制因子或转化为基因激活因子模块,以描绘特定细胞类型中的调控复合物和基因功能 。这些高度进化和多功能的基因编辑工具将极大地塑造 hPSC 作为人类早期发育研究的新平台。
越来越多的证据表明,患者来源的 iPSC 中的家族性基因突变具有很高的穿透性,并且可以在 iPSC 衍生的靶细胞中忠实地重现疾病表型。疾病细胞病理学可以通过 TALEN 或 CRISPR/Cas9 介导的 HR来纠正。鉴于 CRISPR/Cas9 系统的强大功能,研究人员可以通过在同源 iPSC 中使用合成寡核苷酸引入基因缺失或修复来改变疾病进展和严重程度。风险因素的相互作用网络也可以通过多重基因敲除来描绘。CRISPR/Cas9 和 PSC 的组合也提供了一个有价值的系统来研究常见但低风险的遗传因素对非家族性和特发性疾病进展的累积效应,特别是对于神经退行性疾病、糖尿病、动脉粥样硬化和癌症。近年来,全基因组 gRNA 文库(全基因组 CRISPR 敲除筛选 [GeCKO])已建立,用于解析多种癌症细胞系和 hPSC 中的基因功能。这些创新方法将持续为多重打击特发性疾病的病因提供基础而全面的理解,为优化患者的治疗策略铺平道路。
利用基因编辑工具制造 PSC 可以通过在细胞上引入特定标签并纠正 PSC 衍生细胞中的基因突变来扩展精准医疗的应用。在细胞特异性启动子下表达单个或多个特异性报告蛋白可以辅助细胞示踪和细胞分选,以便进一步进行细胞分析和移植。目前,临床应用于治疗 AMD 的 PSC 衍生 RPE 片层是手动分离的,未经细胞分选。未来可能需要对 PSC 衍生细胞进行基因标记,以富集所需的细胞群,例如多巴胺能神经元前体细胞和造血干细胞,从而促进追踪细胞命运、细胞存活率和体内肿瘤发生。
CRISPR/Cas9 系统凭借其简便易用、成本低廉、高效且功能多样的优势,成为人类基因治疗的理想工具。多项基于基因组编辑和多能干细胞 (PSC) 技术的临床试验也揭示了将 SSN/PSC 联合移植疗法应用于现实世界的可能性。SSN/PSC 联合技术不仅可用于治疗遗传疾病,还有望用于治疗艾滋病毒 (HIV) 和癌症。然而,要将 PSC 和基因组编辑工具应用于临床,未来仍需克服一些严峻挑战。
大规模生产临床级、高纯度的工程特定细胞谱系是临床应用面临的第一个挑战。iPSC 的生成、特定细胞谱系的分化和基因组编辑非常耗时耗力,而且成本很高。尤其是在现行良好生产规范 (cGMP) 规范下。为了简化基于 SSN/PSC 的疗法的流程,cGMP 级 HLA iPSC 库是未来十年的必要方法。对于临床 hPSC 制备,需要能够大规模扩增高质量 hPSC 的生物反应器。此外,生成特定的细胞谱系高效分化实验方案是另一大挑战。对于这个问题,基于荧光的细胞分选是纯化特定细胞谱系的理想选择。例如,表面标志、Corin 和富含亮氨酸的重复序列和跨膜结构域 1 (LRTM1) 被用于多巴胺能神经元前体纯化。如前所述,SSN介导的细胞谱系特异性报告基因也可以为细胞纯化提供理想的解决方案。
对于临床治疗,最受关注的问题是安全性。hPSC 固有的致瘤特性仍然是一个挑战。对于临床应用,如何在移植前识别低致瘤风险的 iPSC 克隆并消除未分化的 iPSC 还有改进的空间。此外,CRISPR/Cas9 的脱靶风险是另一个安全挑战。对靶标识别的高错配容忍度和强大的 DSB 活性会造成大量的脱靶突变,这极大地阻碍了基因治疗的临床应用。使用 CRISPR/Cas9 对原代人 CD4+ T 细胞的研究显示出良好的 CCR5 特异性靶向性、可忽略的脱靶突变和 HIV 抗性。然而,在三原核胚胎中测试 CRISPR/Cas9 进行同源重组定向修复时,观察到受精卵基因组中较高的非预期突变。尽管已经开发出几种方法来减少 CRISPR/Cas9 系统的脱靶缺陷,例如前面提到的 Cas9-nickase、dCas9-FokI 二聚体和截短的 sgRNA 寡聚体 ,但在胚胎或基于 PSC 的细胞移植的临床应用之前,必须开发和验证具有高保真度和低不良突变的临床级基因编辑工具。
最近,原始状态hPSC的发现可能有利于原始生殖细胞(PGC)的分化。研究人员还应用CRISPR/Cas9编辑人类胚胎基因组。然而,随着技术的进步,一些伦理争议也随之而来。基于SSN/PSC的技术不仅可能让我们应用于移植疗法,还可能让我们生成修饰的生殖细胞。这是一个重要的伦理问题,在将这些技术应用于人类生殖系改造并影响我们的下一代之前,需要进行详细的讨论。
如何看待用于基因矫正的干细胞治疗?
综上所述,iPSC 与 SSN 基因组靶向工具的结合,为疾病建模和移植治疗提供了新的思路。基于 SSN/PSC 的疗法的致瘤性和脱靶问题或许在不久的将来得到克服,并有望成为常规临床疗法。未来的发展路线图充满挑战,但也充满希望。
(责任编辑:佳学基因)


